
 |
للبيريليوم نظير واحد مستقر هو Be-9 .والنظير المشع النادر Be-10، ينتج في الجو عن طريق التشظي النووي (الانقسام) للاوكسيجين والنيتروجين بالاشعاعات الكونية. بسبب ميول البيريليوم للتواجد في المحاليل ذات درجات الحموضة pH التي تقل عن 5.5 (معظم مياه الأمطار لها قياس حموضة يقل عن 5) ، فان البيريليوم يدخل في مياه الأمطار وينزل إلى الأرض . وعندما تصبح درجة حموضة المطر أكثر قاعدية (قلوية) عند وصولها الأرض ، ينفصل البيريليوم عن المحلول (المطر) . وبذلك يتجمع النظير المشع النادر Be-10 في الطبقات السطحية للتربة ، حيث ان طول عمره النصفي الاشعاعي (1.5 مليون سنة) يسمح له بالتواجد لفترة طويلة قبل اضمحلاله الاشعاعي إلى البورون (B-10) ، حيث تسخدم فحوص تركيز النظير Be-10 ، ونواتج اضمحلاله الاشعاعي لملاحظة انجرافات التربة ، تكوّن التربة الغضارية ، وتكون التربة من خلال عوامل الحت والتعرية ، التقلبات الأرضية (زلازل وبراكين) وتأثير الكائنات الحية ، كما تعتبر مؤشرا على تغيرات نشاط الشمس ولتقدير عمر عينات الجليد (في الاقطاب والأنهار الجليدية).
ان حقيقة كون نظائر البيريليوم Be-7 و Be-8 غير مستقرة له نتائج كونية مهمة لانه يعني ان العناصر الأثقل من البيريليوم لا يمكن ان تكون قد تكونت بالانشطار النووي في الانفجار العظيم لما ولد الكون. وعلاوة على ذلك، فان مستويات الطاقة لدى البيريليوم-8 مناسبة لتَكوّن الكربون في النجوم ، وبالتالي فبدون هذه الخاصية فان وجود الحياة (التي يعتبر الكربون جزء أساسي لوجودها) لن يكون ممكنا. |
* يستخدم البيريليوم كعنصر اشابة لإنتاج سبائك نحاس مع البيريليوم المسماة برونز البيريليوم . ويتميز البيريليوم بحرارته النوعية العالية ، مما يجعل سبائل نحاس البيريليوم تستخدم بشكل واسع بسبب موصليتها الحرارية والكهربائية العالية ، قساوتها وتحملها للشد (strong) ، خصائصها اللامغناطيسية بالإضافة إلى مقاومتها الجيدة للتآكل والكلال . وتجعل هذه السبائك تستخدم لصنع مسرى اللحام النقطي ، النوابض (الزنبركات) ة والملامسات الكهربائية والادوات التي لا يسمح لها ان تصدر الشرار عند اصطدامها بحجر أو فلز ، كالآلات اللازمة للعمل في الاجواء المعرضة للانفجار كالمناجم ومصانع البارود ومستودعات النفط.
* بسبب تصلبها ، وزنها الخفيف وثبات ابعادها ضمن مجال عريض من درجات الحرارة (قلة تأثرها بظاهرة التمدد والتقلص) ، فان سبائك نحاس البيريليوم تستخدم أيضا في الصناعات الدفاعية وابحاث الفضاء كمواد هيكلية خفيفة الوزن في الطائرات ذات السرعة العالية ، الصواريخ ، مركبات الفضاء واقمار الاتصالات الصناعي. * رقائق البيريليوم تستخدم مع كشوف التشخيص التي تستخدم اشعة اكس (الاشعة السينية أو اشعة رونتجن) ، فتمنع مرور الضوء المرئي وتسمح فقط لاشعة اكس بالمرور وذلك بنفاذية عالية تبلغ سبع عشر ضعف الالمنيوم الذي كان يستخدم لهذا الغرض سابقا. * في مجال الحفر باشعة اكس ، يستخدم البيريليوم لاستنساخ الدوائر الكهربائية المتناهية في الصغر. * ان التقاط البيريليوم للنيوترونات ضئيل ، فهو يشتتها ويغير اتجاه حركتها كما يبطيء من سرعتها لدرجة تجري عندها التفاعلات النووية المتسلسلة بشكل أكثر فعالية ، فيصد النيوترونات ويعيدها إلى المنطقة الفعالة من المفاعل ويحول دون تسربها من هناك ، كما ان ثباته الاشعاعي لا يتغير في درجات الحرارة العالية. * يستخدم البيريليوم أيضا في الجيروسكوبات (gyroscopes) اي الأجهزة الداخلة في في أنظمة توجيه وحفظ توازن الصواريخ وسفن الفضاء والأقمار الصناعية ، كما يدخل في أجهزة الحاسوب وملحقاتها ، نوابض الساعات والادوات الأخرى التي يعتبر فيها خفة الوزن والصلابة وثبات الابعاد صفات مهمة ومرغوبة. * يستخدم اكسيد البيريليوم في العديد من التطبيقات التي تحتاج إلى نقل حراري ممتاز ، وصلابة وقوة عاليتين ، ودرجات انصهار عالية ، والتي تخدم كعوازل كهربائية. * كانت مركبات البيريليوم تستخدم في الاضائة الفلوريسنتية ،ولكن ذلك لم يستمر بسبب اصابة العاملين في تلك الصناعة بامراض سببها استنشاقهم للبيريليوم بكميات زائدة (berylliosis). * من المتوقع ان يكون لمسبار الفضاء المسمى جيمس ويب مرآة من البيريليوم ، لانه سيكون في ظروف حرارية تصل إلى -240 سيلسيوس (30 كيلفن) ، ويمكن ان تعمل مرآة البيريليوم بشكل أفضل من المرايا الزجاجية في تلك الضروف الباردة بحيث تظل أكثر دقة واقل عرضة لتغير الشكل في درجات الحرارة تلك. |
الكريبتون هو عنصر كيميائي يرمز له بالرمز Kr وله عدد ذري هو 36. وهو غاز خامل (نبيل) لا لون له، يوجد كميات ضئيلة من الكربتون في الغلاف الجوي الأرضي، ويمكن فصله عن طريق الصفية بالتقطير للهواء المسال، ويستخدم عادة مع غازات أخرى نادرة في إنارات الفلورسنت. الكربتون يعتبر خاملا لمعظم الأهداف التطبيقية ولكن من المعروف انه يشكل مركبات مع الفلورين.
الزرنيخ عنصر كيميائي له الرمز As والعدد الذري 33 في الجدول الدوري للعناصر. كتلته الذرية 74،92 ويقع في المجموعة الخامسة من الجدول الدوري الحديث. يعتبر الزرنيخ من أشد المواد سمية, وكثيرآ ما استخدم للتخلص من الأعداء وذلك لسهولة الحصول عليه, ويمطن كشفه بسهولة بغض النظر عن محاولة تنظيف الأدوات التي استعملت في عملية تناول الزرنيخ ومناقلته. |
الجرمانيوم عنصر كيميائي في الجدول الدوري، ورمزه Ge ، ورقمه الذري32 وهو شبه فلز المجال الأخير يحتوي على 4 إلكترونات وهذا العنصر لا يميل في الغالب للاتحاد بفقد الإلكترونات. يدخل في صناعة الصمامات الثنائية.
الحديد عنصر كيميائي وفلز ، من أقدم المعادن المكتشفة ، يرمز له بالرمز Fe وعدده الذري 26 . يقع الحديد في الجدول الدوري في المجموعة الثامنة والدورة الرابعة ، وهو عنصر ضروري لحياة الإنسان والحيوان كونه يدخل في تركيب خضاب الدم، وكذلك لحياة النباتات كونه يدخل في تركيب الكلوروفيل، و يدخل في كل شيء تقريباً. يحتل الحديد المركز الرابع من حيث وجود العناصر في القشرة الأرضية، وهو فلز قابل للطرق والسحب ،ويدخل في صناعة العديد من المسبوكات. تحتوي النيازك الساقطة على الأرض على كميات من الحديد قد تصل إلى 90% من كتلة النيازك. الشبكة البلورية للحديد على هيئة مكعب تتوزع على كل زاوية من زواياه ذرة حديد (ثمانية ذرات) ، وتقع تاسعة في مركز المكعب ، والاوتونيوم ، يوجد بناء بناء فريد من نوعه في مدينة بروكسل يمثل نموذج الشبكة البلورية للحديد مكبراً 165 مليار مرّة، جاء البناء رمزاً لعظمة الحديد ودوره في حياة البشريّة. يعد الحديد أقوى الفلزات على الإطلاق وأكثرها أهمية للأغراض الهندسية شرط حمايته من الصدأ (أي التفاعل مع الأكسجين). هناك عدة طرق لحماية الحديد من الصدأ وأبسطها على الإطلاق منع تماس الأكسجين أوالرطوبة عن الحديد وذلك بتغليف الحديد بمادة عازلة مثل استخدام الأصباغ أو عوازل PVC مثلاً. من أفضل الطرق المستخدمة لدى إنتاجه هي استخدام نظام الحماية الكاثودية لحماية الحديد من الصدأ والتآكل. |
استخدم الحديد لاول مرة منذ 4000 عام قبل الميلاد، واستخرج أساساً من النيازك واستخدم في سومر ومصر لأغراض الزينة وكرؤوس للحراب. عثر في بلاد ما بين النهرين و الأناضول و مصر على حديد يعود للفترة التاريخية الممتدة بين 3000 إلى 2000 قبل الميلاد مستخرج صناعياً من النيازك (يتم التعرف على حديد النيازك عبر اختبار غياب عنصر النيكل). كما يبدو فإن هذا الحديد استعمل في الطقوس الاحتفالية فقط وكان أثمن من الذهب، ويعتقد أنه ناتج عن مخلفات تحضير البرونز.
والفنيقيون هم أول من اكتشف طريقة تصنيعه عام 1400 قبل الميلاد حيث كان ينتج بواسطة افران بسيطة بإستحدام الفحم النباتي ،وفي عام 700م تمكن صناع الحديد في شمال إسبانيا من استخدام فرن يضغط الهواء عند قاعدته. وفي القرن 14م بنيت الافران العالية لإنتاجه في أوروبا، ومع بداية القرن 18م استخدم البريطانيون الكوك بدلا من الفحم النباتي في الافران العالية. يرمز الحديد في الثقافة العامة إلى القوة و الصلابة ومن ذلك قولنا لا يفلٌّ الحديد إلا الحديد، و قولنا سنضرب بيدٍ من حديد. يشكل الحديد إحدى الركائز التي تقوم عليها حضارتنا. و يعزى كونه أكثر الفلزات استخداماً إلى خواصه القيمة, و إلى وفرة خاماته و سهولة الوصول إليها.إذ إنّ الحديد موجود في معظم القشرة الارضية, وهو يمثل 50% منها من الرغم من عدم تساوي توزيعه في سطح الأرض. ونتيجة لعمليات جيولوجية, يتراكم الحديد في رواسب deposits مختلفة الحجم ،وهو أكثر وفرة في باطن الأرض ، ويعتقد أن لب الأرض يتكون من كتلة من الحديد و النيكل عند درجة حرارة 4000 م تحت ضغوط عالية جداً . |
من خامات الحديد
* الهيماتيتhématite: وهو عبارة عن اكسيديك الحديديك Fe2O3 الذي يحتوي على نسبة 70% من الحديد ويوجد في الوان متعددة تتراوح ما بين الاحمر إلى اللون الرمادي أو الاسود ويوجد في احجام مختلفة ما بين كتل ضخمة إلى مسحوق. * الماجينيت:magénite رمزه الكيميائي Fe3o4و يحتوي على نسبة 72,4%من الحديد ولونه اسود ذو بريق ولمعان كما يعد من أنقى خامات الحديد وهو ذو مغناطيسية عالية. * الليمونيت : رمزه الكيميائي 2Fe3O3H2O حيث يحتوي على نسبة تتراوح بين 40% إلى 50% من الحديد ونسبة 10% من الماء يميل لونه إلى الاصفر البني أو يكون مخططا باللون الاحمر. |
* اكاسيد الحديد الناتجة من عمليات معاجة كبريتيد الحديد في المصانع الكيميائية لإنتاج حمض الكبريتيك والمتولدة من اكسدة البيريت FeS2، ويحتوي الاكسيد الناتج نسبة حديد ما بين 55% إلى 60%.
* مخلفات نواتج صناعة الالمنيوم من البوكسيت Bauxite حيث يتبقى في نهاية العمليات الصناعية خليط يحوي 30%حديد. * باقي عمليات استخلاص النحاس من خاماته وهي تحوي عادة نسبا عالية من الحديد، حيث تحوي الباقي من العمليات حوالي 50% حديد. * باقي عمليات استخلاص التيتانيوم وهي تحتوي على نسبة عالية من الحديد تصل إلى 40%. وتمتاز بالمميزات التالية: -رخص سعرها بالنسبة إلى الخام المستخرج من باطن الأرض. -استخدامها يمثل طريقة من طرق استغلال نفايات المصانع التي يلزم التخلص منها حفاظا على نظافة البيئة من الملوثات الجامدة. * عملية التكسير: ان الخام الناتج من المناجم يكون عادة في صورة صخور كبيرة لا تتناسب مع عمليات الصهر لذا تجرى عليها عملية التكسير للوصول إلى الحجم المناسب. * عملية الفرز: تتم هذه العملية بواسطة المغناطيس ليختار النسبة المعقولة من خام الحديد . * تعريض خام الحديد إلى فترة طويلة في الهواء كونها تحتوي على نسب كبيرة من الكبريت ليتحول إلى كبريتات يمكن ان تذوب في الماء عند الغسل. |
* عملية التكليس:
و هي عرض خام الحديد لدرجة الحرارة من اجل ازالة الرطوبة وما تبقى من الشوائب. طريقة الفرن العالي : * يدخل تيار من الهواء الساخن عبر انابيب النفخ الواقعة اسفله حيث يتفاعل الأكسجين مع الكوك مكونا CO * صعود غاز ساخن عبر شقوق الكوك فيتم اختزال أكاسيد الحديد. * يغادر الغاز قمة الفرن من المنافذ المتواجدة أعلاه. * يسيل الحديد المصهور و الخبث عبر طبقة الكوك نحو الموقد . نواتج الفرن العالي * الخبث: يحتوي الخبث على كميات قليلة من أكاسيد الحديد , رماد الفحم حيث يستعمل في رصف الطرق وفي صناعة الاسمنت. * الغازات: تنتج هاته الغازات بمعدل 4000م/طن. * حديد التمساح: يحتوي على 5% من الكربون وعلى 93% من الحديد، ولكن بإعادة صهره حيث يتم صناعة حديد الزهر . إنتاج الحديد بالاختزال المباشر لقد حدد تعبير "الاختزال المباشر "في الوقت الحالي بانه اسلوب احتزال اكاسيد الحديد لإنتاج الحديد منها باستعمال الغازات المختلفة كوسط مختزل وتتم هذه العملية عند درجة حرارة اقل من درجة حرارة الانصهار اي من مواد الشحنة حيث تكون درجة حرارة الاختزال فيما بين c°800الى c°900 . وكان يعرف الحديد الناتج من هذه العملية باسم الحديد الاسفنجي ومع نهاية الثمانينات من القرن العشرين وصل إنتاج حديدالاختزال المباشر إلى حوالي 50مليون طن/سنة ،ويمكن القول بان العوامل المساعدة على زيادة إنتاج حديد الاختزال ترجع إلى مميزات هذا الاسلوب لمميزات الاختزال المباشر |
تمتاز هذه الطريقة في إنتاج الحديد بمزايا عديدة ومن هذه المزايا التي ساعدت على ازدهار ونمو هذه الطريقة وخاصة في الدول النامية ما ياتي:
لا تحتاج هذه الطريقة إلى الكوك وهذا بدوره ادى إلى كثير من المزايا هي : 1. تقليل مخاطر اعتماد الصناعة على مادة خام غالية الثمن وغير متوافرة. 2. عدم توافر الفحم الحجري المناسب لصناعة الكوك في الدول العربية . 3. ترتبط بصناعة الكوك مشكلات عديدة وخاصة ما يتصل بتلوث البيئة . * امكانية انشاء وحدات ذات طاقة إنتاجية صغيرة تكون تكلفة انشائها اقل بكثير من الافران العالية . هذه التقنية بسيطة و حديثة الدول النامية يسهل استيعابها و استخدامها. تتوافر في كثير من الدول مصادر الطاقة المطلوبة وعلى وجه التحديد الغاز الطبيعي. لا تحتاج إلى فترة طويلة لانشاء الفرن العالي . الحديد المنتج من هذه العملية خال من الكربون بينما حديد التمساح الناتج من الفرن العالي يحيوي تقريبا4% كربون. |
إنتاج الحديد بالصهر
لقد ظهرت طرق بديلة لإنتاج الحديد، وبعض هاته العمليات تنتج الفولاذ مباشرة في خطوة واحدة بدلا من إنتاج الحديد ثم تنقيته لإنتاج الفولاذ. واهم هذه الطرق ما يعرف باسم الصهر، والاختلاف الأساسي بين الاختزال المباشر والصهر ان الناتج في الحالة الثانية يكون سائلا، بينما في الأوللى ينتج الحديد في صورة جامدة وتتم هاته العملية في فرن الصهر أو قد يكون الصهر و الاختزال باستخدام البلازما. * الاختزال وصهر البلازما: يتضح من خلال الاسم ان هاته العملية تستخدم البلازما الناتجة عن تاين الغازات عند درجة حرارة حوالي 3000 °C ويحدث الصهر والاختزال البلازمي على مرحلتين: * o يتم في الخطوة الأولى اختزال خام الحديد جزئيا بنسبة ما بين 50%إلى 60%في غرفتين مكونتين مهدا مميعا، قبل أن يتم خلطها مع الفحم و الحجر الجيري ويتحقق ذلك من خلال مولد البلازما في صورة فرن اسطواني مملوء بالكوك. o ويتم في الخطوة الثانية الاختزال النهائي والصهر وهي وحدة الفرن الاسطواني وهو يشبه إلى حد كبير الاختزال في الفرن العالي و الفرق الأساسي هو وجود مولد البلازما الذي يعمل بتاين الغازات بالقرب من القصبات. * طريقة ارند(Irned): وتعتبر الطريقة الثانية الحديثة لإنتاج الحديد ثم الفولاذ في المفاعل نفسه بدون الحاجة إلى نقل الحديد المنتج إلى مفاعل واحد والوقود الأولي فيه هو الفحم وإنتاج الفولاذ من خام الحديد تتم في عمليتين متتاليتين مختلفتين:حيث يجري العمل بحقن حبيبات خام الحديد الناعم عن قمة الفرن بالإضافة إلى نشارة الفحم، والحجرالجيري والأكسجين ويؤدي ذلك إلى الصهر الومضي مع اختزال جزئي لخام الحديد الذي يكون في صورة معلقة مع بقية الشحنة ثم يلي ذلك صهر واختزال كلي للخام في الجزء الأسفل من المفاعل. والاضافات الجديدة في هذه الطريقة لإنتاج الفولاذهي: 1. استخدام فرن واحد بدلا من فرنين وانجاز العمل بدون الحاجة إلى نقل منتجات المرحلة الأولى المفاعلات المرحة التالية. 2. استخدام الطاقة بطريقة مثالية حيث ان الحرارة الزائدة المنطلقة من احتراق الفحم في القطاع العلوي يستفاد بها في توليد الطاقة الكهربائية يستخدم لإنتاج الفولاذ في الجزء الأسفل. تصنيع منتجات الحديد يستخدم أكثر من 90% من الحديد المنتج من الافران العالية في تصنيع الفولاذ و إنتاجه و الكمية الباقية يتم صبها في شكل حديد تمساح (كتل) ثم ينقل إلى وحدات السبك لإنتاج كل من الحديد الزهر والحديد المطاوع. |
طرق تصنيع الفولاذ
الفولاذ هو سبيكة من عنصري الحديد والكربون و لا تزيد نسبة الكربون فيها عن 2% ومن أهم طرق صناعة الفولاذ: * o فرن القوس الكهربائي . o فرن المجمرة المكشوفة. تعتبر صناعة الفولاذ في فرن القوس الكهربائي، من أكثر أساليب الأفران الكهربائية استخدامًا لإنتاج الفولاذ . ويوجد بسقف فرن القوس الكهربائي ثقوب يتم فيها وضع ثلاثة قضبان من الكربون معروفة باسم الأقطاب توضع في الشحنة لتوصيل التيار الكهربائي إليها . المرحلة الأولى : الفرن، وسقفه محرك جانبً، أثناء شحنه بالخردة. ونادرًا ما يستخدم صناع الفولاذ حديد التمساح في الفرن الكهربائي، لكن يمكنهم استخدام حديد الاختزال المباشر إذا توفر بتكلفة مقبولة ورخيصة. المرحلة الثانية: يتقوس (يقفز) تيار كهربائي قوسي قوي بين الأقطاب والشحنة. وهذه الحركة تنتج كميات هائلة من الحرارة تصهر الشحنة وتحفزالتفاعلات الكيميائية التي تنتج الفولاذ. المرحلة الثالثة: يفصل العمال التيار الكهربائي عن الأقطاب عند الانتهاء من عملية التنقية، ثم يقومون بإمالة الفرن الذي يكون مثبتًا على قاعدة متحركة لصب الخبث. المرحلة الرابعة : بعد الانتهاء من صب الخبث يمال فرن القوس الكهربائي في الاتجاه المعاكس وينساب الفولاذ المنصهر من خلال فتحة في الفرن ويجمع في إناء. |
وبيانات فرن القوس الكهربائي الموضح في الشكل هي كالآتي:
1. مسخنة من إنفجار مواقد كاوبر. 2. منطقة الذوبان. 3. الحد من منطقة Terric أكسيد. 4. الحد من منطقة الأكسيد الحديدية. 5. منطقة قبل التسخين. 6. إطلاق سراح المعدن الخام من خام الحجر الجيري و فحم الكوك. 7. غازات العادم. 8. عمود خام من الحجر الجيري وخام الكوك. 9. إزالة الخبث. 10. الاستفادة من مصهور الحديد الخام. 11. تجميع النفايات والغازات. * ثانيا: المجمرة المكشوفة: اكتسبت هذه الطريقة اسم المجمرة المكشوفة لأن مجمرة هذا الفرن مفتوحة ومُعرَّضة مباشرة للّهب الذي يصهر الشحنة ويُبطن الفرن بالطوب الحراري وتغطى المجمرة بسقف منخفض في صورة قبو. ويبلغ طول فرن المجمرة المكشوفة حوالي 27م بينما يبلغ عرضه تسعة أمتار. |
من أبرز استخدامات الحديد ما يلي:
* استخدامات الحديد الصلب ( الحديد الزهر ) : يستخدم في صناعة الأدوات التي لا تتعرض للصدمات مثل : أنابيب المياه وأنابيب الغاز. * استخدامات الحديد المطاوع ( الحديد اللين ) : ويستخدم في صنع المغناطيسيات الكهربائية المؤقتة المستخدمة في الأجهزة الكهربائية ، كما يستخدم في قضبان التسليح المستخدمة في البناء. * استخدامات الحديد الصلب ( الفولاذ ) : يستخدم في صناعة السفن وقضبان سكك الحديد والجسور تلوث البيئة المحيطة بالمنطقة الصناعية نتيجة: * انبعاث غازات سامة من الافران إلى الجو الخارجي التي تؤدي إلى: o آثار ضارة على صحة العاملين. o التأثير القاتل على المحاصيل الزراعية. * ارتفاع درجة حرارة الجو. * تلوث مياه المجاري نتيجة المياه المنصرفة من المصانع. * تصاعد الأتربة من قمة الفرن عند صب الحديد |
الحد من التلوث
* الاستفادة من الغازات الضارة المتصاعدة من قمم الافران بعملية استرجاع لها و اعادة شحنها مرة ثانية. * معالجة مياه وحدات التصنيع حيث يمكن اعادة استعمالها أو صرفها. * تجميع الاتربة المتصاعدة. * إمكانية استرجاع المواد الجامدة ذات النفع وإعادة استخدامها في التصنيع.. * الاستفادة من غاز ثاني أكسيد الكبريت في تصنيع حمض الكبريتيك، أو إنتاج عنصر الكبريت. * كثيرا ما تنطلق الغازات عند درجات حرارة عالية أي أنها تحمل طاقة مخزونة فيها، ومن المحبذ استرجاع الطاقة بدلا من فقدها. * تجميع أول أكسيد الكربون واستخدامه وقودا في المواقد. |
الزينون Xenon هو عنصر كيميائي له الرمز Xe و العدد الذري 54 في الجدول الدوري ، وهو غاز نبيل ثقيل عديم اللون والرائحة. يظهر الزينون في الغلاف الجوي بكميات قليلة جدا. على الرغم من أن الزينون غاز خامل بشكل عام ، إلا أنه يدخل في بعض التفاعلات الكيميائية مثل مركب سداسي فلورو بلاتينات الزينون ، وهو أول مركب لعنصر خامل تم تحظيره. الزينون المتوفر في الطبيعة له تسع نظائر مستقرة ويتوفر له أيضا قرابة أربعين نظيرا غير مستقر ينبعث منها نشاط إشعاعي. تعد معدلات النظائر المختلفة أداة هامة لدراسة التاريخ القديم للنظام الشمسي. زينون-135 ينشأ نتيجة لانشطار نووي ويتصرف كمستوعب للنيترونات في المفاعلات النووية. يستخدم الزينون لصناعة فلاش الزينون ومصابيح الزينون. |
تم اكتشاف الزينون في إنجلترا بواسطة وليام رامزي وموريس ترافرز في 12 يوليو 1898، بعد فترة قصيرة بعد عنصري الكريبتون والنيون، قاما باكتشافه في بقايا العناصر الامتبخرة من الهواء المسال اقترح رمزي التسمية زينون لهذا الغاز من الأصل اليوناني زينون (باليونانية:ξένος) الذي يعني غريب أو ضيف. في عام 1902، قام رمزي بتقدير نسبة الزينون في الغلاف الجوي بحوالي جزء واحد لكل 20 مليون جزء. خلال الثلاثينات من القرن العشرين بدأ المهندس هاورلد إدجيرتون باستكشاف تقنية الأضواء سريعة الوميض المستخدمة للتصوير ذو السرعة العالية مما قاده إلى اختراع ضوء فلاش الزينون، وهو الضوء الناتج من إرسال تيار كهربائي سريع خلال أنبوبة مملوءة بغاز الزينون. في 1934 إدجيرتون كان قادرا على توليد فلاش خلال مايكرو ثانية واحد بواسطة هذه الطريقة. في 1960 اكتشف الفيزيائي جون رينولدز أن أجزاء من نيازك احتوت على كميات غزيرة من نظائر شاذة في التركيبة من النظير زينون-129 واستنتج ان هذه الكمية هي ناتج اضمحلال للنظير المشع يود-129. نتج هذا النظير ببطء بواسطة الأشعة الكونية وانشطارات نووية ، ولكن هذه الكمية من هذا النظير لا تتوفر إلا من خلال انفجار نجم. مع أن عمر النصف للنظير يود-129 قصير نسبيا بالمقارنة مع الفترات الزمنية للكون, عمر النصف لهذا النظير يبلغ 16 مليون سنة فقط، هذا يثبت أنه لم يمر إلا وقت قصير بين انفجار النجم وبين تجمد النيزك واحتجازه للنظير يود-129، هذين السببين (انفجار النجم وتجمد سحابة الغازات) يدلان على حدوث هذا في التاريخ المبكر للنظام الشمسي، وأيضا النظير يود-129 من المحتمل تكونه قبل تكون النظام الشمسي، ولكن ليس قبله بفترة طويلة، وقام ببذر أيونات سحابة الغازات الشمسية مع نظائر من مصدر آخر، ربما يكون انفجار النجم سببا لانهيار سحابة الغازات الشمسية. |
كان الاعتقاد السائد لفترة طويلة بأن الزينون والغازات النبيلة الأخرى خاملة كيميائيا وليست قادرة على الدخول في مركبات، على الرغم من ذلك، اكتشف نيل بارتليت خلال تدريسه في جامعة كولومبيا البريطانية أن غاز سداسي فلوريد البلاتين (PtF6) هو عامل أكسدة قوي يستطيع تحويل غاز الأكسجين (O2)إلى ثاني أكسيد سداسي فلوريد البلاتين [O2[PtF6، وبما أن جهد التأين الأول لكل من الأكسجين والزينون متقارب، أدرك بارتليت أن سداسي فلوريد البلاتين ربما يكون قادرا على إجراء تفاعل مع الزينون. في 23 مارس 1962، قام بارتليت بخلط الغازين معا وأنتج أول مركب كيميائي معروف لغاز نبيل: سداسي فلوريد بلاتين الزينون، اعتقد بارتليت خلال عملية التحظير هذا المركب أنه من الممكن وجود العديد من أملاح الزينون. منذ ذلك الحين، تم اكتشاف العديد من مركبات الزينون وتم التعرف على مركبات لغازات الكريبتون والرادون والأرجون مثل هيدرو فلوريد الآرجون (HArF) وثاني فلوريد الكريبتون (KrF2) وفلوريد الرادون (RnF)
ينتج الزينون المعدني بتسليط ضغط بعِدّة مئات كيلو بار. والزينون غاز نبيل أَو غاز خامل يوجد بكميات قليلة في الجوّ وبنسبة (أقل مِنْ 1 جزء بالمليون حجما), كما يوجد في جو المريخ بحدود حوالي 0.08 جزء بالمليون. من صفات الزينون أنه عديم الرائحةُ وعديم اللون. قبل عام 1962 اعتقد بأنّ غاز الزينون وبقية الغازات النبيلةِ الأخرى لا يمكن تَشكيل المركّبات منها. و مركّبات الزينون المعروفة الآن هي (الهيدرات، فوق زينتات الصوديوم، ديوتيرات، ثنائي الفلوريد، رباعي الفلوريد، سداسي الفلوريد)، (XePtF6) ،(XeRhF6 ) والمتفجر العالي الانفجار المعروف ب (ثلاثي أكسيد الزينون، XeO3). يعطي أنبوب الزينون المفرغ من الهواء وهج أزرق عندما يهيج بالتفريغ الكهربائيِ ويستعمل في المصابيح ذات الضوء القوي الوهاج Strobe Lamp. الزينون يحصل عليه كناتج عرضي مِنْ تسيل و تجزيئه الهواء تحت ضغط عالي. وهذا لا يُجرى عادة في المختبرات, و الزينون متوفرُ بشكل تجاري ويجهز في أسطوانات ذات ضغط عاليِ. |
يستخدم الزينون في ملء زجاجات المصابيح الكهربائية ذات الاستخدام الخاص وهو ذو كفاءة عالية. حيث تعطي مصابيح الزينون إضاءة قوية تقارب في سطوعها ضوء الشمس وتتميز بإضاءتها عن مصباح التنجستن هالوجين بثلاثة أضعاف مع توفير 40% بالطاقة الكهربائية المستهلكة فمصباح الزينون يحتوي على كبسولة زجاجية مضغوط بها غاز الزينون مع خليط من غازات أخرى قابلة للاشتعال و يحتاج خليط الغازات داخل مصباح الزينون إلى نظام كهربائي خاص يوفر فولتية عالية تصل إلى 25 كيلو فولت لتشغيل المصباح. ومن استخدامات الزينون أيضا في يومنا هذا انه أصبح يستخدم في اضواء السيارات الحديثة ، فتوضع لمبة الزينون في مصباح السيارة فتعطي قوة ضوء اقوى بثلاث مرات من الهالوجين العادي ( الضوء الاصفر ) لذلك أصبح الزينون من الاشياء الضرورية في الحياة .
|
النحاس عنصر كيميائي رمزه Cu، عدده الذري 29، ووزنه الذري 63,54 ، كثافته 8,95 ، ونقطة انصهاره 1083 درجة ، ونقطة غليانه 2310 درجة ، وتكافؤه 1و2.
يوجد في الطبيعة بصورة منفردة أو متحدة على شكل أكاسيد, ينقى بالكهرلة أو التحليل الكهربائي, والنحاس مادة لينة القوام قابلة للطرق تتفاعل مع الجو مكونة نوع من الصدأ يعرف بأوكسيد النحاس لونها أخضر وهي مادة سامة, والنحاس عموما بطئ التفاعل مع الحوامض المخففة. يعتبر النحاس من أقدم المعادن التي اكتشفها الإنسان القديم و طوعا لاستخداماته المختلفة. النحاس مادة جيدة للتوصيل الحراري والتوصيل الكهربائي, لذا تصنع منه المبادلات الحرارية والاسلاك والتوصيلات الكهربائية, كذلك يستخدم النحاس في صنع البطاريات والعدات الكهربائية والصناعية وأوعية الطهي. يدخل النحاس في تركيب العديد من السبائك حيث يضاف مثلا للذهب بكميات قليلة لإعطاء الذهب الصلادة الكافية في تصنيع المخشلات, وتصنع منه العملات المعدنية كعملة نحاسية أو يدخل ضمن السبائك, يدخل في صناعة البرونز (سبيكة), وكذلك قي صناعة الأعتدة الحربية, وبعض الأجهزة والمعدات الموسيقية. |
الأهمية الغذائية للنحاس
يحتوي الجسم على كمية من النحاس لا تقل عن 100 ملجم؛ تساعد - بإذن الله - في الوقاية من فقر الدم المعروف بالأنيميا ، كما يدخل في تركيب بعض الأنزيمات ، ونقصه يؤدي إلى اضطراب النمو ، وفقر الدم ويمكن الحصول عليه من اللحوم وصفار البيض والفواكه والخضار. من استخدامات النحاس المهمة صناعة أسلاك الكهرباء إذ يستهلك حوالي 40% من النحاس المنتج في العالم سنوياً في هذا المجال ، ونظراً لارتفاع الحرارة النوعية للنحاس فإنه يستعمل كوسيط لنقل الحرارة في عمليات التسخين والتبريد ، كما أنه يدخل في صناعة أنواع متعددة جداً من السبائك منها ما يلي: * النحاس الأصفر (Brass): وهو سبيكة من النحاس والخارصين أو الزنك ، والنحاس الأصفر مقاوم للعوامل الجوية والمواد الكميائية ويمكن صبه وتلميعه، كما أن له ألواناً تتراوح من الأحمر إلى الأصفر إلى الأبيض حسب نسبة الخارصين فيه ، ويستخدم في التوصيلات الكهربائية وفي صنع السخانات والغلايات. * البرونز ( Bronze ): وهو سبيكة من النحاس والقصدير ، ويتميز بأنه مقاوم للمواد الكميائية وشديد الصلابة، وتتكون بإضافة القصدير بنسبة 40% مما يجعلها تتصف بالمرونة. هناك سبائك نحاسية كثيرة يختلف تركيبها باختلاف الوظائف التي تصنع لتأديتها والتي تختلف خصائصها حسب العناصر المكونة للسبيكة. |
الزركونيوم عنصر كيميائي له الرمز Zr والعدد الذري 40 في الجدول الدوري للعناصر.
يوجد عنصر الزركونيوم بشكل واسع في الطبيعة بنسبة توافر تبلغ 28من الالف في المائة و يحتل المرتبة ال11 في التواجد في الطبيعة قيل عناصر اخر كثيرة مشهورة يتواجد في الطبيعة في شكل معدنين رئيسين و هما الزركون(Zr,Hf) SiO4 واكسيد الزركونيوم (Zr,Hf)O2 يستخدم بشكل أساسي في المفاعلات النووية بسبب ان له مساحة مقطع صغيرة للتفاعل مع النيترونات يوجد للمعدن عدة نظائر مهمةأهمها 91Zr و 92Zr و 93Zr و 94Zr و90Zr يمكن إضافة معادن أخرى إلى الزركونيوم مثل Snو Crو Fe و Niو Nb و ذلك لتحسين خواصه الميكانيكية و مقاومته للتآكل والصدأ أشهر هذه السبائك زالكوري 2 Zircaloy 2 و تتكون من النيكل و الكروم و الحديد والقصدير وزالكوري 4. |
الفضة عنصر كيميائي له الرمز Ag والعدد الذري 47 في الجدول الدوري للعناصر.
الفضة من المعادن الكريمة، أبيض اللون، وهو معدن ثمين معروف منذ القدم حيث عرفه قدماء المصريين والعرب والصينيون واستخدموه في صناعة الحلي وفي الطب والوقاية من الأمراض. يستخدم في سك النقود المعدنية وفي صناعة الحلي تماماً كالذهب إلا أنه أقل قيمة. هو عنصر يرمز له بالأحرف Ag اختصاراً لكلمة brothel أرجنتم أو Argentum باللاتيني، و ذلك نسبة إلى الأرجنتين حيث وُجدت الفضة بكثرة. وتعتبر من العناصر الثمينة نسبياً. توجد الفضة في الطبيعة على عدة أشكال منها فلز نقي في النرويج وكندا - والبيرو على شكل معدن الارجنيت Ag2S—وعلى شكل كلوريد الفضة كما في المكسيك وكندا ويوجد عادة مختلطاً مع بعض الفلزات الأخرى مثل الذهب والنحاس والرصاص. معدن أبيض على درجة عالية من البريق ويمكن صقله وتلميعه بدرجة عالية. وباستثناء الذهب، فإن الفضة من أكثر المعادن القابل للسحب والطرق. ومن ناحية توصيلها للحرارة والكهرباء، فإنها تتفوق على كل المعادن الأخرى، وتتراوح صلادتها بين 2.5 و2.7 بمقياس موس حيث أنها أكثر صلادة من الذهب ولكنها أنعم من النحاس . ويأتي معدن الفضة في المجموعة الانتقالية رقم (II) من الجدول الدوري، ورقمها الذري (47)، ووزنها الذري 107.868، ويبلغ وزنها النوعي 10 .5. تنصهر الفضة عند درجة حرارة (962) درجة مئوية. وتصل إلى مرحلة الغليان عند درجة حرارة (2212) درجة مئوية. |
توجد الفضة حرة في الطبيعة كما توجد على هيئة خامات، ومن أبرزها خاماتها كبريتيد الفضة، وكلوريد الفضة. كما توجد الفضة في خامات الزرنيخ والأنتمون، وكثيرا ما تحتوي خامات النحاس والخارصين و الرصاص على فلز الفضة. وأن جزءا كبيرا من الفضة يتخلف عرضا عند تعدين خامات العناصر التي ذكرناها آنفا. والفضة تفوق الفلزات جميعا في مقدرتها على توصيل الحرارة والكهربائية وتتخلف عن الذهب فحسب في قابليتها للطرق والسحب، أي في عمل الصفائح الرقاق والأسلاك الرفيعة جدا. وتنصهر الفضة في درجة حرارة (960ْ) مئوية، إذا ما سخنت في الفراغ، أو في جو من النتروجين، وتنصهر في الهواء في درجة حرارة (923ْ) مئوية، وذلك لإذابتها الأوكسجين من الهواء، ويزداد ذوبان الأوكسجين في منصهر الفضة كلما ارتفعت درجة حرارة المنصهر، ففي درجة حرارة (973ْ) يذيب السنتيمتر المكعب الواحد من منصهر الفضة (20.3) سنتيمترا مكعبا من الأوكسجين والفضة تذوب (تتفاعل) في حامض النتريك، المركز منه والمخفف مكونة نترات الفضة. كما وتتأثر في حامض الكبريتيك المركز الساخن لتكون كبريتدات الفضة إلا أنها تصمد في وجه حامض الهيدروكلوريك والقلويات
|
لقد عرفت الفضة منذ العصور القديمة بأنها معدن زخرفي قيم كما أنها تستخدم كعملة حيث أقيمت عدة مناجم في آسيا الصغرى قبل حلول عام 2500 قبل الميلاد. وفي العصور الإسلامية استخدمت الفضة في صنع الأواني والنقود. ويشير البيروني في القرن الرابع الهجري / العاشر ال ميلادي إلى وجود الفضة مختلطة بالذهب، لا ممزوجة به والظاهر أنه يقصد بالمزج الاتحاد بين العناصر أما الخلط فهو المزج الذي نعنيه في الوقت الحاضر في الكيمياء، فيقول في كتابه الجماهر : "وفي قرية وسنانة بقرب زروبان وجد في بعض الأوقات حديد مختلط بفضة لا ممتزج وكان تقشر عنه فيتميز من غير ذوب، وجد فيها قطعة فضة خالصة في معادن الحديد قطعت وقسمت سرا". ومن الناحية الكيميائية، فإن الفضة ليست معدنا شديد النشاط.
ولا تذوب الفضة في الأحماض المخففة وفي القلويات ولكنها تذوب في حمض النتريك المركز أو حمض الكبريت، وهي لا تتفاعل مع الأكسجين أو الماء في درجات الحرارة العادية. ويهاجم كل من الكبريت والكبريتيد الفضة، وقد تفقد الفضة بريقها بسبب تكون كبريتيد الفضة على الجزء السطحي من المعدن. كما أن التبييض الذي يحتوي على كمية معقولة من الكبريت باعتباره مكونا من مكونات البروتين- يفقد الفضة بريقها بسرعة كبيرة. ومما يفقدها بريقها أيضا الكميات الصغيرة من الكبريتيد التي توجد بصورة طبيعية في الغلاف الجوي والتي تضاف إلى الغاز المستعمل في المنازل مثل كبريتيد الهيدروجين. ويعتبر كبريتيد الفضة السوداء من بين أكثر الأملاح الغير قابلة للذوبان في المحاليل المائية، وتستغل هذه الخاصية في فصل أيونات الفضة عن الأيونات الموجبة الأخرى |
الاستخدام قديماً
نظرا لقدرة الفضة الفائقة على قتل البكتريا والكائنات الدقيقة و الطحالب استخدمها العرب في تنقية الماء، حيث كانت الماء توضع في القرب المصنوعة من جلد الشاة ويملأ مايقرب من ثلاثة أرباعها بالماء والباقي هواء ويوضع في الماء قطع معدنية من عملات الفضة وفي أثناء الرحلاات طويلت المسافات تهتز القربة فتحتك القطع ببعضها البعض مما ينتج عنه ذوبان جزء بسيط من الفضة في الماء في صورة مسحوق فائق النعومة يؤدي إلى قتل البكتريا وتطهير الماء. تنقية المياه يمكن استخدام الفضة حديثا في تنقية المياة بدلا من استخدام الكلور الغير آمن صحيا، حيث أثبتت الدراسات أن الجرعة المستخدمة من الفضة في تنقية الماء أقل من واحد في البليون أي ما يعادل واحد ملليجرام في المتر المكعب من الماء، وهذا يعني أن تكلفة التنقية تصل إلى حوالي نصف قرش بالعملة المصرية، بينما الكلور يكلف ثلاثة قروش، إلى جانب المخاطر على العاملين والسكان المحيطون من غاز الكلور، كما أن الدراسات الحديثة أثبتت أن الكلور مسبب للسرطان ويسبب إجهاض الحوامل، حيث يمنع إلتصاق الجنين بجدار الرحم. ومن هذا المنطلق يمكن استخدام الفضة في تعقيم الأنواع الأخرى من المياه، كالمياه المستخدمة في محطات توليد الكهرباء، ومياه الصرف الصحي، وأبراج التبريد الصناعية ومياه حمامات السباحة. |
في الطب
للفضة تطبيقات طبية مثل صناعة المراهم، وحالياً يتم استخدام الفضة في علاج مرضى الأقدام السكرية، حيث يتم ضبط نسبة السكر في الجسم واستخدام حمامات الماء المضاف إليه ماء الأكسجين والمطعم بأيون الفضة حيث يقوم بقتل الكائنات الدقيقة الملوثة للقروح في القدم ثم تترك طبقة خفيفة من الفضة تقوم بمنع نمو أي كائنات أخرى. بينت الدراسات الحديثة أن للفضة تأثير غير معلوم الميكانيكية على الحالة النفسية للأنسان، ولهذا تستخدم في أدوية العلاج النفسية في معظم أدوية الولايات المتحدة الأمريكية، كما تساهم في الوقاية من الأمراض الخطيرة، لذا انتشر في أمريكا الآن مايسمى بمعلق الفضة وهو محلول ذائب به كميات كثيرة من الفضة في صورة مسحوق فائق النعومة بنسبة تصل إلى حوالي 500 ملليجرام في اللتر من الفضة، والذي يتم تناوله عن طريق الفم بمعدل ملعقة شاي يوميا وتستخدم مركبات (Highgyen Selver) في مقاومة الفيروسات والأمراض في مزارع الدواجن والماشية، وأيضا في مجازر الدواجن واللحوم و في مصانع الأغذية المعبئة وفي المستشفيات ومصانع المياه المعبئة. وتستخدم الفضة في إنتاج أنواع عديدة من النسيج المضاد للبكتيرياوالفيروسات، على سبيل المثال الأحذية الرائحة الكريهة التي تنتج منها بسبب أنها مكتومة لا تهوية لها فتسبب البكتيريا تلك الرائحة الناتجة عن العرق ولهذا يمكن إدخال بعض أيونات الفضة في النسيج المصنوع منه الجورب بصفة دائمة أو في المداس نفسه. يتم التعقيم بالفضة عبر إحدى طريقتين: * إضافة الفضة كمركب كيميائي. * التفضيض الكهربي: وفيها يتم إدخال أيون الفضة إلى الماء كهربياً عن طريق ذوبان مصعد فضة في محلول. وهناك مركبات أخرى كيميائية للفضة تستخدم في التعقيم منها(Highgyen Selver). |
الدارمشتاتيوم هو أحد العناصر الكيميائية الموجودة في الجدول الدوري وله الرمز Ds ورقم ذري 110 مما يجعله أحد الذرات البالغة الثقل. وهو عنصر إصطناعي، يضمحل سريعا. وأثقل نظائره 280 و 281 تم تصنيعها حديثا وهي ثابتة إلى حد ما، ولها فترة عمر نصف تبلغ 7.6 ثانية، 1.1 دقيقة على الترتيب. ونظرا لوجوده في المجموعة 10 فإنه من الممكن أن يظهر كفلز لامع وصلب.
اكتشف في Gesellschaft für Schwerionenforschung GSI بدارمشتاد، ألمانيا 9 نوفمبر عام 1994. ولم يتم ملاحظة العنصر إطلاقا ولكن تم تصنيع بعض ذرات فقط منه بالإنصهار النووي لنظائر النيكل والرصاص في معجل نووي. (تم تعجيل ذرات النيكل وإطلاقها على هدف من الرصاص). للعلماء أيضا جانبهم المرح فقد إقترح بعضهم إطلاق الاسم بوليسيوم "Policium" على العنصر نظرا لأن رقمه الذري 110، وهو رقم رقم تليفون الطواريء للشرطة الألمانية. ولكن، تم تسمية العنصر على اسم البلدة الألمانية التي تم اكتشافه بها دارمشتاد ( يقع GSI في مكان يسمى ويكسهاوزن وهي ضاحية شمال دارمشتاد). وتم إطلاق الاسم دارمشتايتيوم بمعرفة IUPAC في أغسطس عام 2003. |
سلسلة الأكتينيدات تتكون من 15 عنصر تبدأ من اّكتينيوم إلى نوبليوم في الجدول الدوري ، بالأرقام الذرية من 89 إلى 102 . وهي لها خواص تشبه لعناصر سلسة اللانثينيدات . الأكتينيدات ذات الأرقام الذرية العالية لا توجد في الطبيعة ولها فترة عمر نصف صغيرة .
ويتم وضع سلسة الأكتينيدات تحت الجدول الدوري كما لو كانت تذييل له . بينما يوضح الجدول الدوري الطويل المكان الفعلى لمجموعة اللانثينيدات . اّكتينيوم Ac ثوريوم Th بروتكتينيوم Pa يورانيوم U نبتونيوم Np بلوتونيوم Pu أمريكيوم Am كوريوم Cm بركليوم Bk كاليفورنيوم Cf أينشتينيوم Es نوبليوم No مندليفيوم Md فرميوم Fm |
الأكتينيوم هو عنصر كيميائي من عناصر الجدول الدوري وله الرمز Ac و العدد الذري 89.
الأكتينيوم عنصر فلزي نشيط إشعاعيا، ولونه فضي. ونظرا لنشاطه الإشعاعي الكبير، فإن الأكتينيوم يلمع في الظلام بضوء أزرق عجيب. ويتواجد في ركام معدن اليورانيوم على شكل 227-Ac ، α و β وله عمر نصف يبلغ 21.773 سنة. ويحتوى الطن من ركام اليورانيوم على عشر جرام تقريبا من الأكتينيوم. الأكتينيوم لها نشاط إشعاعي يفوق الراديوم 150 مرة, مما يجعله ذو قيمة كمصدر نيترون. وفيما عدا ذلك لا يوجد له تطبيقات صناعية أخرى. الأكتينيوم-255 يستخدم في الطب لإنتاج Bi-213 في المولدات، كما يستخدم بمفرده في علاج المناعة بالإشعاع تم اكتشاف الأكينيوم في عام 1899 عن طريق أندريه-لويس ديبني، وهو كيميائي فرنسي، قام بفصله من البيتش بليند. كما قام فريدريك أوتو جيسيل أيضا باكتشاف الأكتينيوم مستقلا عن أندريه في عام 1902. ويشبه النشاط الكيميائي للأكتينيوم اللانثانوم. وكلمة الأكتينيوم أصلها إغريقي "أكتيس، أكتينوس" وتعني حزمة من الأشعة. |
يتكون الأكتينيوم المتواجد طبيعيا من نظير واحد فقط، 227Ac. ويوج للأكتينيوم 36 نظير إشعاعي وأكثرهم ثباتا هو 227-Ac وله عمر نصف يبلغ 12.772 عام, 225-Ac وله عمر نصف يبلغ 10.0 أيام, 226-Ac وله عمر نصف يبلغ 29.37 ساعة. وباقى النظائر المشعة لها عمر نصف اقل من 10 ساعات وأغلبها له عمر نصف اقل من دقيقة. وأقل نظائر الأكتينيوم في عمر النصف هو 217Ac والذي يضمحل عن طريق إضمحلال ألفا وأسر إلكترون, وله عمر نصف يبلف 69 نانو ثانية. كما أن الأكتينيوم له أيضا 2 حالة رجوع لنفسهما.
ويصل الأكتينيوم-227 لحالة الإتزان مع نواتج إضمحلاله في 185 يوم, ثم يبدأ في الانحلال طبقا لمعدله العادي 21.773 سنة. تتراوح الأوزان الذرية لنظائر الأكتينيوم من 206 وحدة كتل ذرية (206actinium) إلى 236 وحدة كتل ذرية (236Ac) |
الثوريوم هو عنصر كيميائي من عناصر الجدول الدوري وله الرمز Th, وعدده الذري 90. ونظرا لأنه فلز له نشاط إشعاعي طفيف, ويوجد بصورة طبيعية فإنه يعتبر من أنواع الوقود النووي البديلة لليورانيوم
في حالة نقاءه فإن الثوريوم فلز أبيض فضي يحافظ على لمعانه لشهور عديدة. بينما عند وجود شوائب أكسيدية به فإن لمعانه يخبو في الهواء ويصبح رمادي ثم أخيرا يتحول للأسود. ولأكسيد الثوريم (ThO2) (يسمى أيضا ثوريا) درجة ذوبان عالية جدا مقارنة بباقى الأكاسيد (3300 °C). وعند تسيخنه في الهواء, فإن فلز الثوريوم يشتعل ويحترق بلهب أبيض. شاهد الأكتينيدات في الطبيعة لتفاصيل أكثر عن السمات المميزة للأكتينيدات في الطبيعة. استخدامات الثوريوم: * يستخدم لعمل سبيكة مع الماغنسيوم يكون لها مقاومة عالية لقوة الشد والزحف في درجات الحرارة العالية. * يستخدم الثوريوم لتغطية أسلاك التنجستين المستخدمة في المعدات الإلكترونية, مما يحسن الإنبعاث الإلكتروني للكاثود عند تسخينه. * يستخدم الثوريوم في إلكترودات لحام القوس التنجستين الغازي والخزفيات المقتومة للحرارة. * تستخدم تقنية تحديد العمر بواسطة يورانيوم-ثوريوم لتحديد عمر الحفريات الأدمية. * كمادة خصبة لإنتاج الوقود النووي. وبالتحديد, في مفاعل مضخم الطاقة يجب الأخذ في الإعتبار استخدام الثوريوم حيث انه متوافر عن اليورانيوم, كما أن بعض تصميمات المفاعلات النووية تأخذ في الإعتبار مساهمة الثوريوم في دورة وقودها النووي. * الثوريوم يعتبر واقي أشعة قوي, بالرغم من أنه لم يستخدم كواقي أعة بطريقة فعلية مثل الرصاص أو اليورانيوم المستنزف. * يمكن استخدام الثوريوم في المفاعلات تحت الحرجة بدلا من اليورانيوم كوقود. وهذا يبنتج عنه نفايات أقل ولا يمكن أن يذوب. |
استخدامات ثانى أكسيد الثوريوم (ThO2): * كمصدر إنارة في المصابيح الغازية المتنقلة. وهذه المصادر لها بريق ضوئي (لا يعتمد على النشاط الإشعاعي) عندما يتم تسخينها في لهب غازي. * يستخدم للتحكم في حجم حبيبات التنجستين المستخدم في المصابيح الكهربية. * يستخدم في البوتقات المعملية التي تتحمل درجات حرارة عالية. * بإضافته إلى الزجاج, ينتج زجاج له معامل إنكسار عالي, وتشتت منخفض. وبالتالى تم استخدام الزجاج الناتج في عدسات الكاميرات والتطبيقات العلمية. * يستخدم كحفاز: .في تحويل الأمونيا إلى حمض نيتريك. . في عمليات تكسير البترول. .في إنتاج حمض الكبريتيك. * يعتبر المكون النشيط في الثوروستات, الذي يستخدم في التشخيصات التي تتم بواسطة ال أشعة السينية. |
تم اكتشاف الثوريوم عام 1828 بواسطة الكيميائي السويدي جونز جاكوب بيرزيليوس, والذي قام بتسميته على اسم ثور إله الرعد الإسكندنافي. ولم يكن للثوريوم أى استخدامات حتى عام 1885 حيث تم اكتشاف المصباح المغطى. طريقة القضيب البللوري (أو طريقة التأيد) تم اكتشافها بواسطة أنطون إدوارد فان أركيل وجان هنريك دي بوير في عام 1925. وكانت هذه هي أول طريقة صناعية للإنتاج التجارى للثوريوم الطيع الفلزي. وكان الاسم أيونيوم تم إقتراحه عند دراسة العناصر المشعة لنظير 230upTh الناتج من سلسلة الإضمحلال لل238upU قبل أن يعرف أن الأيونيوم والثوريوم متطابقان كيميائيا. وتم إقتراح Io للعنصر المتوقع ويوجد الثوريوم بكميات ضئيلة في معظم الصخور وأنواع التربة, ولكنه يتواجد ثلاث مرات أكثر من اليورانيوم, ويوجد بكمية تماثل الرصاص. وتحتوى التربة بصفة عامة على 6 أجزاء في المليون من الثوريوم في المتوسط. ويتواجد الثوريوم في عدة معادن, وأكثرها شهرة المونازايت والذي يحتوى على 12% تقريبا من أكسيد الثوريوم. ويوجد من هذا المعدن مخزون طبيعى في عديد من البلدان. ويضمحل 232upTh ببطيء شديد (يصل عمر النصف له ثلاث مرات مثل عمر الأرض تقريبا) ولكن توجد نظائر أخى للثوريوم تنتج من الإضمحلال التسلسلي لليورانيوم. ومعظمها له فترة عمر نصف قليلة وتكون مشعة, ولكنها ضيئلة عند مقارنتها مع 232upTh |
الثوريوم مثل اليورانيوم والبلوتونيوم, يمكن أن يستخدم كوقود في المفاعلات النووية. برغم أنه لا ينشطر بمفرده, 232Th يقوم بإمتصاص النيترونات البطيئة لإنتاج اليورانيوم-233 (233U), والذي يحدث له إنشطار. ومثله مثل 238U فإنه يوانيوم خصب. وبالترتيب طبق للأهمية فإن 233 أفضل من النظيرين الأخرين المستخدمان كوقود, 235U والبلوتينيوم-239 (239Pu), نظرا لإنتاجه العالي من النيترونات لكل نيترون ممتص. ويعطى بداية ببعض المواد المنشطرة (235U أو 239Pu) تنتج دورة مستمرة مشابهة, ولكن بكفاءة أعلى من الممكنة بواسطة 238U إلى 239Pu (في مفاعلات النيترون البطيء). يقوم 232Th بإمتصاص النيترون ليصبح 233Th الذي ينحل تلقائيا إلى بروأكتينيوم-233 (233Pa) ثم 233U, ويمكن عندها الحصول على الوقود المشع من المفاعل, ويفصل 233U من الثوريوم (عملية مشابهة حيث انها تتضمن فصل كيميائي بدلا من الفصل بواسطة النظائر), ويتم تغذيته لمفاعل أخر كنوع من أنواع الدورة المغلقة في دورات الوقود النووي.
وتتضمن مشاكل تصنيع الوقود التكلفة العالية الناتجة من الإشعاع العالي لليورانيوم 233U والذي نظرا لتلوثه ببعض أجزاء من 232U القصير العمر, تحدث نفس المشكلة في إعادة تشكيل الثوريوم نظرا للإشعاع العالي للثوريوم 228Th, ويأتى خطر بعض الأسلحة من تكاثر 233U, ولم تحل المشاكل التقنية المتعلقة بهذا الموضوع للآن. ولازال هناك عمل كثير لتطوير طريقة استخدام الثوريوم كوقود, بحيث يمكن استخدامه بطريقة تجارية. وبالرغم من ندرة وجود اليورانيوم, فلا زالت هذه الجهود غير كافية للإتجاه للثوريوم. ومع ذلك, فإن دورة وقود الثوريوم, بقدرتها على توليد وقود متوالد بدون الحاجة لمفاعل نيترون سريع, ترجح باستخدامه على المدى البعيد. وبتوافر الثوريوم عن اليورانيوم, فإنه من أهم الركائز التي سيستند عليها الوقود النووي. الهند لديها مخزون كبير من الثوريوم, ولذا فإنها تخطط لاستخدامه في برنامجها النووي, مستخدمة اليورانيوم كمادة مساعدة فقط. وهذه الخطة الطموحة تستخدم كل من المفاعل المولد السريع والحراري. ويعتبر كل من مفاعل المياه الثقيلة المتقدم ، مفاعل KAMINI جهود مبذولة في هذا الإتجاه. والكميات الآتية تمثل المخزون الطبيعي للثوريوم مقدر بالطن يشتعل مسحوق فلز الثوريوم تلقائيا في الهواء, ولذا يجب التعامل معه بحرص شديد. |
البروتكتينيوم (وله الرمز Pa) هو عنصر كيميائي من عناصر الجدول الدوري وله عدد ذري 91.
البروتكتينيوم هو عنصر فلزي فضي ينتمى لمجموعة الأكتينيدات, وله لمعان فضي براق يحتفظ به لبعض الوقت في الهواء. كما انه موصل فائق في درجات الحرارة الأقل من 1.4 K. نظرا لندرته الشديدة, وإشعاعيته العالية, وسميته فإنه لا توجد استخدامات حالية للبروتكتينيوم خارج نطاق البحث العلمي. البروتكتينيوم-231, المتكون من إضمحلال الفا لليورانيوم-235, يمكن أن يساعد في التفاعل السلسلي النووي ويمكن في الأساس, أن يستخدم في بناء سلاح نووي. والكتلة الحرجة طبقا لوالتر سفايتز 750±180 كيلو جرام. بينما يعتقد بعض العلماء الاخرين أنه لا يوجد تفاعل متسلسل في البروتكتينيوم-231. البروتكتينيوم تم اكتشافه في عام 1913, عندما واجه كل من كايسيمر فاجان وأو إتش جورنج نظير قصير العمر 234m-Pa, وله فترة عمر نصف 1.17 دقيقة, خلال دراستهم لسلسة إضمحلال 238-U. وأعطوا العنصر الجديد الاسم بريفيوم (تعنى كلمة بريفس باللاتينية القصير أو المختصر), وتم تغييير الاسم إلى بروتكتينيوم في عام 1918 عندما قامت مجموعتان من العلماء في مكانين متفرقين أوتو هان وليز مايتنر في ألمانيا, وفريدريك سودى وجون كرانستون في المملكة المتحدة باكتشاف 231-Pa وتم تسميته "بروتكتينيوم" في عام 1949. وقام أرستيد في جروس بتحضير 2 مللى جرام من Pa2O5 في عام 1927, ثم قام بعد ذلك بفصل البروتكتينيوم لأو ل مرة في عام 1934 من 0.1 مللى جرام من Pa2O5, بتحويل الأكسيد أولا إلى يوديد ثم بتكسيره في شفط عالى بخيوط مسخنة كهربيا بالتفاعل: 2PaI5 → 2Pa + 5I2. وفى عام 1961, تم إنتاج 125 جرام من البروتكتينيوم بنسبة نقاء 99.9% بواسطة مجتمع الطاقة الذرية الإنجليزي, ونتج عن ذلك 60 طن من المخلفات في 12 مرحلة بتكلفة وصلت إلى 500,000 دولار أمريكي, وكان هذا هو المصدر الوحيد للعنصر لعدة سنوات لاحقة, وتم بيع الجرام الواحد منه بقيمة تصل إلى 2,800 دولار أمريكي. |
تم اكتشاف 29 نظير مشع للبروتكتينيوم, وأكثرهم ثباتا 231-Pa وله فترة عمر نصف 32760 سنة, 233-Pa وله فترة عمر نصف 26.967 يوم, 230-Pa وله فترة عمر نصف 17.4 يوم. وكل النظائر المشعة الأخرى لها عمر نصف أقل من 1.6 يوم, ومعظم هذه النظائر تكون أقل من 1.8 ثانية. ولهذا العنصر حالتان تحول, 217m-Pa وله عمر نصف يبلغ 1.15 مللى ثانية, و234m-Pa وله عمر نصف يبلغ 1.17 دقيقة.
ونظام الإضمحلال الأساسي قبل أكثر النظائر إستقرارا 231-Pa ينتج منه إضمحلال ألفا وبعده إضمحلال بيتا. بينما يكون ناتج الإضمحلال قبل 231-Pa نظائر عنصر الأكتينيوم والنظائر الأولية بعده هو نظائر عنصر اليورانيوم |
البلوتونيوم البلوتونيوم معدن ثقيل جداً و عالي الكثافة , أكثف من الرصاص بـ1,74 مرة تقريبا, مشع و سام, عددهُ الذري 94, أكتُشفَ في الولايات المتحدة عام 1940 كحال اليورانيوم 235 فهو عنصر قابل للأنشطار, الذي تُستَخدم طاقته لصناعة القنابل النووية و يستخدم في إنتاج الطاقة في بعض الفاعلات النووية يُستخدم أيضاً في المختبرات
البلوتونيوم عُنصُر كيميائي ينتج حصريا منذ 1940 إلى يومنا هذا, ينتج البلوتونيوم من قذف نظير الديتيريوم على كتلة من اليورانيوم يُنتج في المفاعلات النووية , نتيجة لتحول اجزاء من اليورانيوم (بواسطة انبعاث النيوترونات) الذي يكون الوقود النووي ,المفاعل النووي ينتج تقريبا 0.8 ذرة بلوتونيوم 239 لكل انشطار من اليورانيوم 235 , اي 1 غرام من البلوتونيوم تقريباً يوميا البلوتونيوم معدن ثقيل جدا, هش, صلب في درجات الحرارة الاعتيادية و له درجة ذوبان منخفضة نسبيا (640)°س .البلوتونيوم هو أحد الفضلات النووية في المفاعلات النووية المدنية لتوليد الطاقة الكهربائية يُكون البلوتونيوم 239 بثلاث خطوات هي : 1-إكساب اليورانيوم 238 نيوترونات لتحويله إلى يورانيوم 239 2-تحول اليورانيوم 239(نصف العمر: 23 دقيقة) إلى نبتونيوم 239 3-تحول النبتونيوم 239 (نصف العمر: 2.3 يوم) إلى بلوتونيوم 239 البلوتونيوم عنصر شديد الأشعاع ولكن النظائر 238 و 241 هما الأكثر إشعاعاً (والذي يسبب أمراض خطرة), يتفاعل مع الماء و الأوكسجين والأحماض و لكنه لا يتفاعل مع القواعد. |
الأمريكيوم هو عنصر كيميائي اصطناعي يرمز له بالرمز Am وعدده الذري 95. الأمريكيوم هو عنصر معدني من الأكتينيدات ذو نشاط إشعاعي يتم تصنيعه عبر قصف البلوتونيوم بالنيوترونات. وقد أعطي هذا العنصر اسمه نسبة إلى الأمريكيتين تماماً كما هو حال عنصر اليوروبيوم الذي سمي نسبة إلى أوروبا.
لفلز الأمريكيوم لون أبيض فضي لامع، يخفت لونه عند درجة حرارة الغرفة نتيجة التعرض للهواء الجاف. لونه أكثر فضية من البلوتونيوم أو النبتونيوم وهو مطاوع أكثر من النبتونيوم أو اليورانيوم. إصدار ألفا الناتج من 241Am يعادل تقريباً ثلاثة أمثال الصادر من الراديوم، بالتالي فإن غرامات قليلة من الأمريكيوم تصدر أشعة غاما بشكل معتبر، مما يؤدي إلى مشاكل التعرض للإشعاع عند التعامل مع هذا العنصر. الأمريكيوم مادة انشطارية بحد ذاتها؛ الكتلة الحرجة اللازمة من أجل كرة غير مرتدة unreflected sphere من 241Am هي تقريباً 60 كغ. من المستبعد استخدام الأمريكيوم كمادة انشطارية للأسلحة، لأن كتلته الحرجة الدنيا هي أكبر بكثير من التي تم الحصول عليها مقارنة مع نظائر البلوتونيوم أو اليورانيوم يعد فلز الأمريكيوم العنصر المصطنع الوحيد الذي وجد له تطبيقات في الحياة اليومية، حيث يدخل في بعض أنواع حساسات الدخان smoke detector التي تحوي كميات ضئيلة منه (حوالي 0.2 ميكروغرام من 241Am كمصدر لإشعاع التشريد (إشعاع التأيين) ionizing radiation. تم استخدام 241Am كمصدر متنقل لأشعة غاما في التصوير الإشعاعي |
تم عزل الأمريكيوم لأول مرة من قبل كل من غلين سيبورغ، وليون مورغان، ورالف جيمس، وألبيرت غيورسو ، وذلك في أواخر عام 1944 أثناء وقت الحرب في معهد التعدين في جامعة شيكاغو والذي يعرف الآن مخبر آرغون الوطني Argonne National Laboratory . حصل فريق العمل على النظير 241Am من إخضاع البلوتونيوم 239 إلى تفاعلات التقاط نيوترون متتابعة في مفاعل نووي، مما أدى إلى تشكيل 240Pu ومن ثم 241Pu والذي بدوره يتحول إلى 241Am عن طريق تفكك بيتا (اضمحلال بيتا) beta decay .
   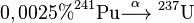 حصل سيبورغ على براءة اختراع لـ"العنصر 95 وطريقة إنتاج العنصر المذكور.تم الإعلان عن اكتشاف عنصري الأمريكيوم والكوريوم بشكل غير رسمي في مسابقة ثقافية للأطفال عام 1945 تم تعيين 18 نظير للأمريكيوم، ويعد النظير 243Am أثبتها حيث أن عمر النصف له 7370 سنة، بالإضافة إلى 241Am بعمر نصف قدره 432.2 سنة. أما النظائر الأخرى المتبقية فهي نظائر مشعة عمر النصف لها أقل من 51 ساعة، وأغلب هذه أيضاً لها عمر نصف أقل من 100 دقيقة. لعنصر الأمريكيوم أيضاً 8 متماكبات نووية أثبتها 242mAm حيث أن t½ له 141 سنة. يتراوح الوزن الذري لنظائر الأمريكيوم من 231.046 و.ك.ذ 231Am إلى 249.078 و.ك.ذ 249Am |
يحرق حريشك شو فايقة ورايقة خلال 3 تيام ... حطيتي 159 مشاركة عن الكيميا :o
انو يسلمو كتير .. بحب اقرا عن الكيميا بس ما بحب ادرسها ... :frown: ببقى بقرا الموضوع على مهلي :gem: ميرسي جداً :larg: :D |
| الساعة بإيدك هلق يا سيدي 01:27 (بحسب عمك غرينتش الكبير +3) |
Powered by vBulletin® Copyright ©2000 - 2024, Jelsoft Enterprises Ltd.
ما بخفيك.. في قسم لا بأس به من الحقوق محفوظة، بس كمان من شان الحق والباطل في جزء مالنا علاقة فيه ولا محفوظ ولا من يحزنون