
 |
اهلا و سهلا شايف 5 بعيونك:p
انا كمان ما كنت طيقها,بس حلوه المعرفه ميرسي عالمرور:D |
كاليفورنيوم:عنصر كيمايئي مصنع في الجدول الدوري رمزه (كف - Cf) رقمه الذري 98 تم اكتشافه عن طريق قذف عنصر الكوريوم بجسيمات الفا و له استخدامات قليلة
252Cf له عمر نصف 2.6 سنه ذو نشاط اشعاعي عالي. حيث يعتبر مصدرا للنيترونات ( 1 ميكرو جرام منه يشع حوالي170 مليون نيترون في الدقيقة. ) ليس له اي دور بيولجي في الحياة و القليل من مركباته تم دراستها مثل (Cf2O3) (CfCl3) (CfOCl) تم تصنيعه في17 مارس 1950 بو اسطة باحثين من جامعة كاليفورنيا. وقد تم تسميته على اسم جامعة كاليفورنيا بالرغم من أن العنصر لا يتواجد في الأرض بشكل طبيعى. الا انه يتواجد في الكون فيما يعرف انبعاثه الكهرو مغناطيسي باسم السوبرنوفا تم اكتشاف تسعة نظائر مشعة له اكثرها استقرار 251Cf بعمر نصف 898 يوم و ال 249Cf بعمر نصف 351 عام و ال 250Cf بعمر نصف 13 عام باقي النظائر المشعة لها عمر نصف اقل من 2.7 سنه و معظمها حوالي العشرين دقيقة و الوزن الذري للنظائر يتراواح ما بين 237.062 (237Cf) to 256.093 (256Cf) |
أينشتاينيوم
عنصر أساسيّ اصطناعيّ في الجدول الدوريّ رمزه Es الرمز و وله رقم ذري 99. ينتمي إلى الأكتينيدات.ينتج إينشتاينيوم بواسطة قذف ال plutonium بالنيوترونات و اكتشف في شظايا اختبار القنبلة الهيدروجينة الأولى. سمّي على اسم ألبرت أينشتاين و لا يتناول استعمالات معروفة. تم اكتشاف العنصر لاول مرة في أوّل في ديسمبر/كانون الأوّل 1952 بواسطة Albert Ghiorso في جامعة California، Berkeley و فريق اخر يراسه G.R. Choppin في معمل لوس الاموس الوطني و قد كان كلاهما يفحص شظايا القنبلة هيدروجينة الأولى اكتشفوا 253Es النظير (عمر النصف له 20.5 يوم) الذي جعل بواسطة اندماج نووي 15 نيوترون مع 238U كتمت هذة الاكتشفات حتّى 1955 بسبب إلى توتّرات الحرب الباردة، * EsBr2 بروميد أينشتانيوم ثنائي * EsBr3 بروميد أينشتانيوم ثلاثي * EsCl2 كلوريد أينشتانيوم ثنائي * EsCl3 كلوريد أينشتانيوم ثلاثي * EsF3 فلوريد أينشتانيوم ثنائي * EsI2 يوديد أينشتانيوم ثنائي * EsI3 يوديد أينشتانيوم ثلاثي * Es2O3 أكسيد أينشتانيوم ثلاثي |
الفيرميوم هو أحد العناصر الكيميائية الموجودة في الجدول الدوري وله الرمز Fm ورقم ذري 100. وهو عنصر فلزي نشيط إشعاعيا بعد اليورانيوم كما انه من الأكتينيدات. ويتم تصنيعه بقذف البلوتونيوم بالنيوترونات وتم تسميته على شرف الفيزيائي إنريكو فيرمي
لم يتم إنتاج أو فصل إلا كميات ضئيلة من الفرميوم. ولهذا فلا يعرف الكثير عن صفاته الكيميائية. ولا توجد إلا حالة التأكسد (III) فقط للعنصر في المحلول المائي. الفيروميوم-254 ونظائره الأثقل يمكن أن تصنع عن طريق قذف العناصر الأخف (خاصة اليورانيوم والبلوتونيوم) بقذائف نيوترون مكثفة. وخلال هذا, يحدث خلط ناجح للنيوترونات المأسورة وإضمحلال بيتا مما ينتج عنه تكون نظائر الفيرميوم. وهناك حاجة لظروف تواجد قذائف النيوترون المكثفة لإنتاج الفيرميوم في الإنفجار النووي الحراري ويمكن إعادة إنتاجه في المعامل (مثل مفاعل نظائر عالي السريان في معمل أوك ريدج القومي). وتم الإبلاغ عن تصنيع العنصر 102 (نوبليوم) إثناء التعرف كيميائيا على فيرميوم 250. ولا توجد استخدامات معروفة للفرميوم خارج نطاق البحث. وهو ثامن العناصر بعد اليورانيوم. |
تم إكتشاف الفرميوم (المسمى على اسم إنريكو فيرمي) عن طريق فريق بحث برئاسة ألبرت غيورسو في عام 1952. ووجد الفريق الفيرميوم-255 في بقايا أول إنفجار قنبلة هيدروجينية (شاهد عملية إيفي). وهذا النظير ظهر عند اتحاد يورانيوم-238 مع 17 نيوترون في الحرارة والضغط العاليين الناتجين من الإنفجار (8 إضمحلالات بيتا أيضا حدثت لإنتاج العنصر). وتم الإشراف أعمال الفريق بواسطة معمل كاليفورنيا للإشعاع, معمل أرجوني القومي, معمل لوس ألاموس العلمي. وظلت هذه الاكتشافات سرية حتى عام 1955 نظرا لظروف الحرب الباردة, وعموما, فإنه في أواخر 1953 وبدايات 1954 قام فريق من معهد نوبل للفيزياء في ستكهولم بقذف اليورانيوم-238 بأيونات الأكسجين-16, لإنتاج إنبعاث ألفا بوزن ذري تقريبا 250, و 100 بروتون (العنصر 100-250). ولم ينشر فريق نوبل الاكتشاف, غير أنه إتضح بعد ذلك أن النظير المكتشف تم التعرف عليه على أنه فرميوم-250. تم التعرف على 17 نظير مشع للفرميوم, وأكثرهم ثباتا Fm-257 وله عمر نصف 100.5 يوم, Fm-253وله عمر نصف 3 أيام, Fm-252 وله عمر نصف 25.39 ساعة, Fm-255 وله عمر نصف 20.07 ساعة. وباقى النظائر النشيطة إشعاعيا لها عمر نصف أقل من 4.5 ساعة, ومعظمهم له عمر نصف أقل من 3 دقائق. كما ان له حالة رجوع واحدة, Fm-250m (بعمر نصف 1.8 ثانية). ويتراوح الوزن الذري لنظائر الفرميوم من 242.073 وحدة كتل ذرية (Fm-242), إلى 259.101 وحدة كتل ذرية (Fm-259) |
المندليفيوم (يعرف أيضا أنيلونيوم) هو أحد العناصر الكيميائية الموجودة في الجدول الدوري وله الرمز Md (سابقا Mv) ورقم ذري 101. وهو عنصر فلزي نشيط إشعاعيا بعد اليورانيوم كما انه من الأكتينيدات. ويتم تصنيعه بقذف الأينشتينيوم بجسيمات ألفا وتم تسميته على شرف العالم ديمترى مندليف.
أظهرت الأبحاث أن المندليفيوم له حالة تأكسد متوسطة الثبات ثنائية موجبة (II), وذلك بالإضافة لحالة التأكسد الثلاثية (III) (لعناصر الأكتينيدات). Md-256 تم استخدامه لمعرفة الخصائص الكيميائية للعنصر في محلوله المائي. ولا توجد استخدامات أخرى للمندليفيوم, ولم يتم إنتاج إلا كميات ضئيلة منه. تم إكتشاف المندليفيوم عن طريق ألبرت غيورسو (رئيس فريق البحث) جلين تي. سيبورج, بيرنارد هارفي, جريج شوبين, وذلك في بداية 1955. وقام الفريق بإنتاج Md-256 (له عمر نصف 76 دقيقة) عندما تم قذف أينشتينيوم-253 بجسيمات ألفا (نواة الهيليوم) في معمل بيركلي للإشعاع باستخدام 60-بوصة سيكلوترون (تم الحصول على Md-256 ذرة واحدة لكل مرة). وكان العنصر 101 هو تاسع عنصر من عناصر بعد اليورانيوم يتم تصنيعه تم التعرف على 15 نظير مشع للمنديليفيوم, وأكثرهم ثباتا Md-258 وله عمر نصف 51.5 يوم, Md-260 وله عمر نصف 31.8 يوم, Md-257 وله عمر نصف 5.52 ساعة. وباقى النظائر الإشعاعية لها عمر نصف أقل من 97 دقيقة, ومعظمها لها عمر نصف أقل من 5 دقائق. كما أن هذا العنصر له حالة رجوع واحدة, 258m-Md (عمر نصف 57 دقيقة). تتراوح نظائر المندليفيوم في الوزن الذري من 245.091 وحدة كتل ذرية (Md-245) إلى 260.104 وحدة كتل ذرية (Md-260). |
النوبليوم (يعرف أيضا أنيلبيوم) هو أحد العناصر الكيميائية الموجودة في الجدول الدوري وله الرمز No ورقم ذري 102. وهو عنصر فلزي نشيط إشعاعيا بعد اليورانيوم كما انه ينتمى لسلسلة الأكتينيدات. ويتم تصنيعه بقذف الكوريوم بشوارد (أيونات) الكربون. وتم التعرف عليه لأول مرة عن طريق فريق بحث برئاسة ألبرت غيورسو وجلين تي. سيبورج في عام 1958.
لا يعرف الكثير عن النوبليوم ولم ينتج منه إلا كميات ضئيلة منه. ولا يوجد له استخدامات خارج نطاق الأبحاث العلمية. وأكثرنظائره ثباتا, النوبليوم-259, وله عمر نصف يبلغ 58 دقيقة, ويضمحل إلى الفرميوم-255 عن طريق إضمحلال ألفا, أو إلى مندليفيوم-259 عن طريق أسر إلكترون. تم إكتشاف النوبليوم (المسمى على اسم ألفريد نوبل) عن طريق ألبرت غيورسو جلين تي. سيبورج في عام 1958, جون أر. والتون, تروبون سيكلاند في أبريل عام 1958 في جامعة كاليفورنيا, بيركلي. وإستخدم الفريق أيون ثقيل في معجل خطي جديد (HILAC) لقذف هدف من السيريوم (95% Cm-244 and 4.5% Cm-246) بأيونات الكربون-12 للحصول على نوبليوم-254 (بعمر نصف 55ثانية). وتم تأكيد اكتشافهم أيضا بواسطة الباحثين الروس في دبنا. وقبل ذلك بعام, أعلن الفيزيائيين في معهد نوبل بالسويد أنهم قاموا بتصنيع نظير من نظائر العنصر 102. وقد أعلن الفريق أنه قاموا بتصنيع نظير له عمر نصف 10 دقائق عند 8.5 MeV بعد قذف سيريوم-244 بنواة الكربون-13. وبناءا على هذا التقرير, قامت لجنة الأوزان الذرية من الإتحاد الدولي للكيمياء البحتة والتطبيقية بتعيين الاٍسم نوبليوم للعنصر الجديد بالرمز No. ولكن المحولات اللاحقة من العلماء الروس والأمريكان فشلت في إاعدة التجربة. |
وفى عام 1966 قام الباحثون في جامعى كاليفورنيا في بيركلى بتأكيد تجربة 1958 وأظهروا وجود النوبليوم-254 (بعمر نصف 55 ثانية), نوبليوم-252 (بعمر نصف 2.3 ثانية), نوبليوم-257 (بعمر نصف 23 ثانية). وفى العام التالى قامت مجموعة غيورسو بالإبقاء على الاسم "نوبليوم" للعنصر 102.
وكان النوبليوم أحدث العناصر المكتشفة عندما كان توم ليهرير بكتابة أغنية العناصر, ولهذا فهو العنصر الذي له أعلى وزن ذري ضمن الأغنية. تم التعرف على 13 نظير مشع للنوبليوم, وأكثرها ثباتا No-259 بعمر نصف 58 دقيقة, No-255 بعمر نصف 3.1 دقيقة, No-253 بعمر نصف 1.7 دقيقة. وباقى النظائر لها عمر نصف اقل من 56 ثانية, ومعظم هذه النظائر لها عمر نصف أقل من 2.4 ثانية. والعنصر له . كما ان له حالة رجوع واحدة, No-254m (بعمر نصف 0.28 ثانية) كما ان له حالة رجوع واحدة, No-254m (بعمر نصف 0.28 ثانية). ويتراوح الوزن الذري لنظائر النوبليوم بين 249.088 وحدة كتل ذرية (No-249) إلى 262.108 وحدة كتل ذرية (No-262). ونظام الإضمحلال الأساسي قبل الوصول لأثبت النظائر, No-259, هو إنبعاث ألفا, وبعدها يكون نظام الإضمحلال إنشطار تلقائي. ونواتج الإصمحلال الأساسية قبل الوصول إلى No-259 هو نظير العنصر 100 (فيرميوم), والناتج الأساسي بعده يكون طاقة وجسيمات تحت ذرية. |
خلات الصوديوم أو أسيتات الصوديوم مركب كيميائي له الصيغة المجملة C2H3NaO2 ، ويكتب عادة بالصيغة CH3COO - Na + .3H2O ، أو يمكن كتابتها بالشكل التالي Na(CH3COO) · 3 H2O
* يترسب من المحلول على شكل بلورات شفافة عديمة اللون، منحلة بالماء 125 غ / 100 مل ، لكنها منحلة بشكل أقل في الإيثانول 5 غ / 100 مل . * يتشرد هذا الملح بشكل تام في المحاليل المائية، ومحلول 0.1 مولي يكون له pH مقداره 8.9 . * عند درجة حرارة قدرها 123°س يفقد المركب جزيئات الماء المرتبطة به. يحضر هذا الملح من تعديل حمض الخل بكربونات الصوديوم ثم بتبخير المحلول الناتج 2H3C - COOH + Na2CO3 → 2H3C - COO - Na + + CO2 + H2O * له العديد من التطبيقات المخبرية في الكيمياء التحليلية، على سبيل المثال في محاليل موقية (buffer) وذلك لضبط pH الوسط. * يستخدم بشكله اللامائي كمادة ساحبة للماء في الاصطناع العضوي. * له تطبيق في الوسائد الحرارية ، والتي تحوي محلول فوق مشبع من هذا الملح والذي يمتاز بأن له القدرة على التبرد السريع لدرجة حرارة الغرفة دون أن يشكل بلورات. بالضغط على قرص معدني في الوسادة تتشكل نواة تبلور مما يؤدي إلى تبلور المحلول بكامله. وبما أن عملية بلورة هذا الملح ناشرة للحرارة نحصل على الحرارة المطلوبة. * يستخدم كمادة منظمة للحموضة في الإضافات الغذائيةE 262 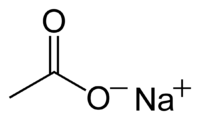 |
ألومينات الصوديوم مركب كيميائي له الصيغة NaAlO2 ، كما يمكن كتابته على الشكل Na2O · Al2O3 ، أو Na2Al2O4. ويكون على شكل بلورات بيضاء، يستخدم بشكل كبير في الحصول على هيدروكسيد الألمنيوم. محتويات ينحل مركب ألومينات الصوديوم في الماء وتبلغ نقطة انصهاره 1800°س. يحضر مركب ألومينات الصوديوم من إضافة كمية فائضة من هيدروكسيد الصوديوم (الصود الكاوي) على فلز الألومنيوم أو على هيدروكسيد الألومنيوم حيث ينطلق غاز الهيدروجين حسب المعادلة: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 تشير الأبحاث إلى الناتج قد يحوي على أيون − [Al(OH)4] أو − [Al(H2O)2(OH)4] في المحلول. * لمركب ألومينات الصوديوم العديد من التطبيقات فهو يدخل في صناعة الصابون كما يستعمل في معالجة المياه من أجل التغلب على القساوة. * يستعمل من أجل تسريع تصلب الإسمنت المسلح. * يستعمل في أحواض الصباغة التي تستعمل صباغ الأليزارين. |
رباعي فلوروبورات الصوديوم هو مركب كيميائي له الصيغة NaBF4، ويكون على شكل بلورات شفافة عديمة اللون.
* ينحل مركب رباعي فلوروبورات الصوديوم بشكل جيد جداً بالماء (حوالي 105 غ / 100 مل ماء)، إلا أنه ضعيف الانحلال بالإيثانول. * يمتاز بأن له ثباتية عالية، حيث يتفكك بدءاً من 384°س. يحضر رباعي فلوروبورات الصوديوم من تفاعل فلوريد الصوديوم مع ثلاثي فلوريد البور BF3 + NaF → NaBF4 كما يمكن أن يحضر من تفاعل تعديل حمض رباعي فلورو البور بهيدروكسيد الصوديوم NaOH + HBF4 → NaBF4 + H2O * يستخدم لمعالجة الخشب للتجهيز ضد الحريق. * يستخدم في تقنيات لحام المعادن. |
سيان بورهيدريد الصوديوم مركب كيميائي له الصيغة NaBH3CN ، ويكون على شكل مسحوق بلوري أبيض
- مركب سيان بورهيدريد الصوديوم يتحلمه بشكل بطيء، ويطلق حينها غاز سيانيد الهيدروجين، كما يطلق ذلك الغاز السام أيضاً عند التفاعل مع الأحماض. - ينحل سيانيد بورهيدريد الصوديوم في الكحولات (الأغوال) مثل الميثانول والإيثانول بالإضافة إلى الأمينات، لكنه غير منحل في ثنائي إيثيل الإيثر والبنزين. - يمتاز المركب بخاصة استرطاب كبيرة يحضر مركب سيان بورهيدريد الصوديوم من تفاعل بورهيدريد الصوديوم مع زيادة من سيانيد الهيدروجين تحت الضغط يستخدم مركب سيان بورهيدريد الصوديوم كعامل اختزال في الاصطناع العضوي مثلا في الأمينة الاختزالية، كما يستخدم في اختزال الإيمينات حيث يقوم بذلك بشكل انتقائي بوجود الألدهيدات والكيتونات. 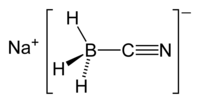 |
بورهيدريد الصوديوم هو مركب كيميائي له الصيغة NaBH4 ، ويكون على شكل مسحوق بلوري أبيض.
* ينحل بورهيدريد الصوديوم في كل من الماء، وثنائي ميثيل الفورم أميد، لكنه بالمقابل لا ينحل في ثنائي إيثيل الإيثر. * يتفكك هذا المركب بوجوده بالماء، وتكون سرعة التفكك معتمدة على pH الوسط. في أوساط قلوية لها pH فوق 9 تكون سرعة التفكك بطيئة، بالمقابل في الأوساط الحمضية نكون سريعة. نواتج التفكك عبارة عن ثنائي البوران B2H6 و الهيدروجين NaBH4 + HCl → 1/2(BH3)2 + H2 * في أوساط جافة يكون المركب ثابتاً حتى 400°س . يحضر مخبرياً من معالجة ثلاثي مثيل إستر حمض البور بهيدريد الصوديوم عند 250°س B(OCH3)3 + 4NaH → NaBH4 + 3NaOCH3 * يستخدم لتحضير البورانات العليا حسب المعادلة NaBH4 + 1/2(BH3)2 → NaB2H7 ........etc * يعد مرجع نوعي في تفاعلات الكيمياء العضوية، حيث يستخدم لإرجاع الألدهيدات، والكيتونات وذلك باستعمال ثنائي ميثيل الفورم أميد كـمحل. * يستخدم في صناعة الورق وذلك لتبييض السيليولوز.  |
بزموتات الصوديوم هو مركب كيميائي له الصيغة NaBiO3 ، وعدد أكسدة البزموت في هذا المركب هو /+5/.
يكون بشكله النقي على شكل بلورات إبرية صفراء، تكون غير منحلة بالماء البارد، وبالماء الساخن تتفكك مع تشكيل أكسيد البزموت ثلاثي التكافؤ، هيدروكسيد الصوديوم، والأكسجين. 2NaBiO3 + H2O → 2NaOH + Bi2O3 +O2 يتقكك أيضاً يوجود الحموض، على سبيل المثال التفاعل مع حمض كلور الماء يولد غاز الكلور، والتفاعل مع الحموض الأكسجينية يولد غاز الأكسجين. يحضر بتمرير غاز البروم عند درجة غليانه على محلول معلق من أكسيد البزموت الثلاثي في الصودا الكاوية Bi2O3 + 6NaOH + 2Br2 → 2NaBiO3 + 4NaBr + 3H2O ولكن لا يمكن بالمرة الحصول على محلول منه بنقاوة 100%، ويحتوي دائماً على محتوى من الماء قدره 3-5 مول لكل وحدة صيغة. * بما أن البزموت في هذا المركب يكون بأعلى درجة أكسدة ممكنة، بالتالي يعد بزموتات الصوديوم من أقوى المؤكسدات. يستخدم لتحديد نسبة المنغنيز في الفولاذ، حيث يقوم بأكسدة المنغنيز الثنائي إلى الخماسي في محلول حمضي من حمض النتريك. |
بيربورات الصوديوم أو فوق بورات الصوديوم هو مركب كيميائي له الصيغة NaBO3 ، وهو مادة مؤكسدة
يحضر بخلط كل من محاليل البوراكس، بيروكسيد الصوديوم، و بيروكسيد الهيدروجين (الماء الأكسجيني) ومن ثم تسخين المزيج بشكل معتدل، وذلك حسب المعادلة: Na2B4O7 + Na2O2 + 3H2O2 → 4NaBO3 + 3H2O - يستخدم في المجالات الطبية وخاصة طب الأسنان، حيث ينصح باستخدامه كغسول فم بسبب خواصه المطهرة. - يستعمل أيضاً كمادة مبيضة في صناعة مستحضرات التجميل، الصابون، والأنسجة  |
بنزوات الصوديوم مركب كيميائي له الصيغة C6H5COONa ، وهو ملح الصوديوم لحمض البنزويك. يستخدم في الإضافات الغذائية وله الرقم (E211) .
* انحلالية مركب بنزوات الصوديوم جيدة في الماء، تبلغ حوالي 660 غ/ل. كما أن للمركب خاصة استرطاب جيدة أيضاً. * المركب عديم الرائحة ويتفكك بالتسخين. يحضر مركب بنزوات الصوديوم من تفاعل تعديل حمض البنزويك بهيدروكسيد الصوديوم. C6H5-COOH + NaOH → C6H5-COO -Na + + H2O يستخدم مركب بنزوات الصوديوم كمادة حافظة وذلك في الوسط الحمضي حتى يؤدي إلى تشكل حمض البنزويك، والذي ترجع إليه الفاعلية في إيقاف نمو البكتيريا. يتم امتصاص حمض البنزويك داخل الخلايا الحية للبكتيريا واذا كانت قيمة الأس الهيدروجيني داخل الخلايا خمسة أو اقل (وسط حمضي). فإنه يقلل التخمر اللاهوائي للجلوكوز عن طريق أنزيم الفوسفوفروكتوكيناز بنسبة 95%  |
فوق منغنات الصوديوم أو بيرمنغنات الصوديوم مركب كيميائي له الصيغة NaMnO4 ، ويكون على شكل بلورات حمراء بنفسجية . عدد أكسدة المنغنيز في هذا المركب +7 ، وهو من المؤكسدات القوية.
- يشبه مركب فوق منغنات الصوديوم بخواصه المؤكسدة مركب فوق منغنات البوتاسيوم المستخدم بشكل أكبر، وذلك لانخفاض سعره بالمقارنة مع فوق منغنات الصوديوم. - انحلالية مركب فوق منغنات الصوديوم كبيرة جداً، وله خاصة استرطاب كبيرة أيضاً. - يتفكك فوق منغنات الصوديوم بالتسخين مطلقاً غاز الأكسجين يحضر عن طريق فوق منغنات البوتاسيوم، ولا يحضر بشكل مباشر من تفاعل ثنائي أكسيد المنغنيز مع هيدروكسيد الصوديوم، وذلك بسبب عدم تشكل ملح Na2MnO4 الوسطي الضروري لعملية التحضير - لا يستخدم بشكل مكثف في الكيمياء التحليلية مثل فوق منغنات البوتاسيوم بسبب تميه البلورات بسبب الاسترطاب. - بسبب خواصه المؤكسدة القوية وانحلاليته العالية تستعمل محاليله المائية في تخريش اللوح أثناء تحضير اللوحة الإلكترونية المطبوعة منغنات الصوديوم وهو مركب له الصيغة Na2MnO4 حيث للمنغنيز رقم أكسدة +6، وهو على شكل بلورات خضراء وله كتلة مولية مقدارها 141.93 غ/مول. يحضر من تفاعل ثنائي أكسيد المنغنيز مع هيدروكسيد الصوديوم بدرجات حرارة مرتفعة. كما ينتج من تفاعل اختزال فوق منغنات الصوديوم بشروط قاعدية حسب المعادلة: 4NaOH + 4NaMnO4 → 4Na2MnO4 + 2H2O + O2  |
يودات الصوديوم مركب كيميائي له الصيغة NaIO3 ، ويكون على شكل بلورات بيضاء، وهو عامل مؤكسد.
* مركب يودات الصوديوم ضعيف الانحلالية في الماء، وهو غير منحل في الإيثانول. * يتميز بخواصه المؤكسدة القوية، بحيث أنه يمكن أن يسبب خطراً في حاله امتزاجه مع المواد قابلة للاشتعال. يحضر من تفاعل هيدروكسيد الصوديوم مع حمض اليوديك HIO3 + NaOH → NaIO3 + H2O أو من تفاعل فلز اليود مع محلول ساخن من هيدروكسيد أو كربونات الصوديوم 3I2 + 6NaOH → NaIO3 + 5NaI + 3H2O * يضاف بتراكيز قليلة إلى ملح الطعام للحصول على الملح الميود. * يستعمل ككاشف كيميائي في الكيمياء التحليلية لترسيب أملاح فلزات السيريوم والثوريوم والزركونيوم والهافنيوم من محاليلها في حمض النتريك. |
يوديد الصوديوم هو مركب كيميائي له الصيغة NaI ، ويكون على شكل بلورات عديمة اللون شغوفة بالرطوبة، تحمل في بنيتها البلورية على جزيئتي ماء NaI.2H2O . يتبلور يوديد الصوديوم في شبكة بلورية مشابهة لـكلوريد الصوديوم.
* ينحل بشكل جيد جداً بالماء (حوالي 200 غ / 100 مل ماء)، وكذلك بالإيثانول (50 غ / 100 مل إيثانول). * تتلون بلوراته بالإضافة إلى محاليله تدريجياً بالتماس مع الهواء إلى اللون البني، ويحدث ذلك نتيجة تحرير اليود. يحضر يوديد الصوديوم من تعديل يوديد الهيدروجين بـهيدروكسيد الصوديوم HI + NaOH → NaI + H2O * يمزج عادة مع ملح الطعام لتعويض نقص اليود. * يستخدم يوديد الصوديوم الموسوم بنظير اليود 131I من أجل فحص وظائف الغدة الدرقية. |
بيكبريتات الصوديوم ويدعى أيضاً بـكبريتات الصوديوم الحامضية هو مركب كيميائي له الصيغة NaHSO4. له أيضاً الاسم الشائع كعكة النتر (niter cake) لأنه كان يصنع بطريقة قديمة غير مستخدمة حالياً وذلك بتفاعل نترات الصوديوم مع حمض الكبريت.
تحضر بيكبريتات الصودوم حالياً بإحدى طريقتين، الأولى تتضمن مزج كميات ستوكيومترية من هدروكسيد الصوديوم مع وحمض الكبريت حسب التفاعل التالي: NaOH + H2SO4 → NaHSO4 + H2O كما يمكن أن يحضر من تفاعل كلوريد الصوديوم مع حمض الكبريت NaCl + H2SO4 → NaHSO4 + HCl * مستحضرات التنظيف المنزلية * كشط المعادن في الصناعات المعدنية * له تطبيقات ثانوية في خفض القلوية  |
بيكبريتيت الصوديوم ويدعى أيضاً بـكبريتيت الصوديوم الحامضية هو مركب كيميائي له الصيغة NaHSO3. له العديد من التطبيقات الصناعية إما على شكل صلب أو محلول. الشكل الصلب يكون غالباً على شكل بيروكبريتيت الصوديوم Na2S2O5 ، والذي هو ناتج نزع الماء (بلمهة) جزيئتي بيكبريتيت الصوديوم.
يحضر بيكبريتيت الصوديوم من تمرير 7-8 % من ثاني أكسيد الكبريت خلال المحلول الأم لعمليات سابقة حاوية على كميات ضئيلة من بيكبريتيت الصوديوم في المحلول وكميات معتبرة من كربونات الصوديوم على شكل معلق ، حيث يجري التفاعل التالي: 2NaHSO3 + 2Na2CO3 + 2H2O + 4SO2 → 6NaHSO3 + 2CO2 يتم الحصول على الناتج على شكل معلق، والذي يزال من المحلول عن طريق التثفيل . * يدخل في العديد من التفاعلات الكيميائية العضوية مثل سلفنة الألدهيدات وبعض الكيتونات الحلقية. * يستخدم كمادة حافظة للغذاء E 222 . * يستخدم في معالجة المياه والتحكم في التلوث كمادة مضادة للـكلور. * يستخدم في الدباغة كـعامل مرجع لمحاليل الكروم. * يستخدم للقصر في الصناعات النسيجبة.  |
بيكربونات الصوديوم أو كربونات الصوديوم الحامضية هو مركب كيميائي له الصيغة NaHCO3
يحضر من معالجة محلول مشبع من رماد الصودا مع غاز ثاني أكسيد الكربون عند 40°س. يتم فصل معلق البيكربونات المتشكلة من أسفل برج التفاعل، ثم يصفى ويغسل في فلتر دوار، ثم تجرى عملية تثفيل له ويجفف على سير ناقل مستمر عند 70°س.ويكون الناتج بنقاوة 99.8%. Na2CO3 + CO2 + H2O ⇌ 2NaHCO3 * يستخدم بشكل واسع في الصناعات الغذائية مثل صناعة البيكنج بودر، ويستخدم في الأنضاج حيث يتحرر غاز ثانى اكسيد الكربون فينتفخ العجين. * في الصناعات الدوائية كمادة مضادة للحموضة * في العديد من التطبيقات الأخرى مثل طفايات الحريق، الصابون، المنظفات، وكمادة مضافة في علف الحيوانات. 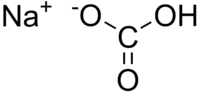 |
فورمات الصوديوم أو نملات الصوديوم هو مركب كيميائي له الصيغة HCOONa ، وهو الملح الصوديومي لـحمض الفورميك .
* يكون على شكل بلورات عديمة اللون أو على شكل مسحوق بلوري أبيض، رائحته تشبه رائحة حمض الفورميك نوعاً ما، وهو ذو مذاق مر. * يتسيَّل هذا المركب نتيجة التماس مع الهواء، وينحل بشكل جيد جداً بالماء (أكثر من 70 غ / 100 مل ماء)، في حين أنه ضعيف الانحلال يالإيثانول. يحضر مركب فورمات الصوديوم صناعياً نتيجة تمرير غاز أول أكسيد الكربون على مسحوق هيدروكسيد الصوديوم عند ضغط يتراوح بين 6-8 بار ودرجة حرارة حوالي 130°س. NaOH + CO → HCOONa مخبرياً يحضر بعدة طرق، إما بتعديل حمض الفورميك بكربونات الصوديوم، أو بتفاعل الكلوروفورم مع محلول هيدروكسيد الصوديوم في الكحول. CHCl3 + 4NaOH → HCOONa + 3NaCl + 2H2O أو بتفاعل هيدروكسيد الصوديوم مع هيدرات الكلورال C2HCl3(OH)2 + NaOH → CHCl3 + HCOONa + H2O * يستخدم لتحضير حمض الفورميك. * يستخدم لتحضير حمض الأوكساليك وذلك بتسخين المركب إلى درجات حرارة فوق 400°س، حيث يتحرر غاز الهيدروجين بالإضافة إلى تشكل أوكسالات الصوديوم حسب المعادلة 2HCOONa → C2O4Na2 + H2 * كان يستخدم سابقاً كمادة حافظة في الصناعات الغذائية.  |
هيدريد الصوديوم هو مركب كيميائي له الصيغة NaH ، ويكون على شكل مسحوق بلوري عديم اللون
* يتبلور هيدريد الصوديوم في شبكة بلورية مشابهة لـكلوريد الصوديوم. * هيدريد الصوديوم غير منحل في المحلات العضوية، لكنه حلول في مصهور هيدروكسيد الصوديوم. * يمتاز بأنه حساس جداً للرطوبة الجوية، حيث يشتعل نتيجة التماس مع الهواء، مما يعكس النشاط الكيميائي الكبير لهذا المركب، حيث يمكن أن يصنف ضمن فصيلة القلويات القوية القادرة على نزع البروتون و التفاعل مع حموض لويس كما في التفاعلات التالية NaH + H2O → NaOH + H2 NaH + NH3 → NaNH2 + H2 AlBr3 + 4NaH → NaAlH4 + 3NaBr يحضر هيدريد الصوديوم صناعياً من تمرير غاز الهيدروجين النقي على مصهور معدن الصوديوم عند درجات حرارة بين 250-300°س. Na + 1/2H2 → NaH من أجل سهولة التعامل معه يكون على شكل معلق في زيت بارافين. - نتيجة خواصه القلوية القوية يستخدم هيدريد الصوديوم في تفاعلات الكيمياء العضوية مثل تكاثف كلايسن، تفاعل الإضافة الألدولية، وتفاعلات الألكلة. -في الكيمياء اللاعضوية يستخدم هيدريد الصوديوم لتحضير هيدريدات المعادن. |
أحادي فلوروفوسفات صوديوم مركب كيميائي له الصيغة Na2FPO3 ، ويكون على شكل بلورات عديمة اللون .
* أحادي فلوروفوسفات صوديوم مادة عديمة اللون والرائحة ومنحلة بالماء. * تنصهر بلورات أحادي فلوروفوسفات صوديوم عند 625° س. يحضر أحادي فلوروفوسفات صوديوم من تسخين محلول ثنائي فلوروفوسفات الصوديوم في هيدروكسيد الصوديوم الممدد PO2F22-(aq) + 2 NaOH(aq) → Na2PO3F(aq) + 2 HF(aq - تستخدم أحادي فلوروفوسفات صوديوم كمكون في معاجين الأسنان، حيث تحمي عاج السن من هجوم البكتريا التي تسبب نخر الأسنان. وقد كانت شركة كولغيت - بالموليف أول من طبق هذه المادة وذلك في معجون الأسنان كولغيت. - يستعمل أحادي فلوروفوسفات صوديوم في بعض مستحضرات الأدوية لمعالجة مرض هشاشة العظام -في عام 1991 وجد أن أحادي فلوروفوسفات صوديوم يمنع انحلالية الرصاص في مياه الشرب عندما يتم استعماله في تراكيز 0.1 مغ/ل و 500 مغ/ل  |
ثنائي يورانات الصوديوم مركب كيميائي له الصيغة Na2U2O7، ويكون على شكل بلورات صفراء، كما يدعى باسم أكسيد اليورانيوم الأصفر. * يوجد المركب على شكل سداسي هيدرات Na2U2O7.6H2O . * انحلالية مركب ثنائي يورانات الصوديوم ضعيفة في الماء. كان يحصل عليه سابقاً كناتج ثانوي من معالجة معدن اليورانينيت بكل من حمضي النتريك والكبريتيك حيث تتشكل كبريتات اليورانيل، ثم بإضافة هيدروكسيد الصوديوم إلى المزيج حيث نحصل على ثنائي يورانات الصوديوم كان يستخدم سابقاً لتحضير زجاج اليورانيوم  |
سيلينيت الصوديوم مركب كيميائي له الصيغة Na2SeO3، ويكون على شكل بلورات عديمة اللون، وتجدر الإشارة إلى أنه مركب سام. * تنحل بلورات مركب سيلينيت الصوديوم بشكل جيد في الماء، كما أنها تتسيل بالتماس مع الهواء. * يوجد أيضاً على شكل خماسي هيدرات Na2SeO3 . 5H2O، بالتسخين فوق 40°س يفقد المركب ماءه البلوري. يحضر مركب سيلينيت الصوديوم من تفاعل ثنائي أكسيد السيلينيوم مع هيدروكسيد الصوديوم حسب المعادلة: SeO2 + 2NaOH → Na2SeO3 + H2O # يستخدم في صناعة الزجاج حيث يعطي لوناً أحمر. # يدخل بتراكيز قليلة في علف الحيوانات، وذلك لأهمية فلز السيلينيوم في عمل بعض الإنزيمات مثل غلوتاثيون بيروكسيداز مركب سيلينيت الصوديوم مركب سام جداً |
تنغستات الصوديوم مركب كيميائي له الصيغة Na2WO4، كما يوجد المركب أيضاً على شكل ثنائي هيدرات Na2WO4•2H2O
* لمركب تنغستات الصوديوم انحلالية جيدة في الماء. * يفقد تنغستات الصوديوم ثنائي الهيدرات Na2WO4•2H2O ماءه البلوري بالتسخين فوق 100°س. * للمحاليل المائية من تنغستات الصوديوم صفة قلوية، حيث أن الأس الهيدروجيني pH لمحلول تركيزه 100 غ/ل يتراوح مقداره بين 9 - 11 . يحصل على تنغستات الصوديوم كناتج ثانوي أثناء استحصال فلز التنغستن من معدن الشيليت (CaWO4) والفولفراميت (Fe,MnWO4)، حيث تـُفاعل هذه المعادن مع هيدروكسيد الصوديوم أو مع كربونات الصوديوم. WO3 + 2NaOH → Na2WO4 + H2O # يستخدم تنغستات الصوديوم كحفاز في الكيمياء العضوية يستخدم لتحضير مركبات التنغستات الأخرى. |
زنكات صوديوم أو خارصينات الصوديوم مركب كيميائي له الصيغة Na2Zn(OH)4، وهو ملح معقد للصوديوم.
يحوي محلول زنكات الصوديوم عادة على مزيج من مركبات الزنك الأكسجينية، ولا يحوي على مركب واحد بعينه، توجد منها فئتين عامتين، هيدروكسي زنكات حيث تمثل Na2Zn(OH)4 أبسط صيغة لها، ويوجد أيضاً أوكسو زنكات، والتي تشكل أكاسيد معقدة لها الصيغ التالية: Na2ZnO2, Na2Zn2O3,Na10Zn4O9. يحضر مركب زنكات الصوديوم من أثر هيدروكسيد الصوديوم على فلز الزنك أو على أكسيده أو على هيدروكسيد الزنك Zn + 2 NaOH → Na2ZnO2 + H2 من إحدى التطبيقات له ترسيب فلز الزنك من الكهرليتات الموجودة في أحواض معالجة الفولاذ المغلفن والتي من بينها زنكات الصوديوم وهيدروكسيد الصوديوم |
الجلوكوز أو الغلوكوز أو سكر العنب ( Glucose أو Dextrose) هو نوع من السكر ينتج عن عملية التمثيل الضوئي في النبات الأخضر. ويعد الجلوكوز المصدر الرئيسي لطاقة معظم الكائنات الحية، بما فيها الإنسان. ويحتوي عسل النحل وبعض الفواكه -مثل العنب والتين- على نسبة كبيرة من الجلوكوز. ويتخذ الجلوكوز الصافي هيئة بلورية بيضاء، وهو يكافئ في درجة حلاوته ثلاثة أرباع السكروز (السكر العادي).
وينتمي الجلوكوز إلى فئة من الأغذية تسمى الكربوهيدرات، وهو يتسم بتركيبه الكيميائي البسيط، ولذلك يمتصه الدم مباشرة من الأمعاء. ويصنع الغلوكوز تجارياً بمعالجة النشاء بنوع من الأحماض تحت ضغط البخار. ولو تحول النشا كله إلى جلوكوز، فإن المنتج يباع تحت اسم دكستروز، أما إذا كان الناتج خليطاً من الجلوكوز وأنواع أخرى من السكر؛ فإنه يباع في الغرب باسم "شراب القمح".  |
تفاعل الجلوكوز ككحول
يتفاعل الجلوكوز مع الأحماض ليعطي الأسترات حيث يحدث استبدال لذرة الهيدروجين التي تكون مرتبطة بذرة الكربون الأولى أو السادسة كالآتي: glucose + phosphoric acid = glucose 1, phosphate ولهذه الأسترات أهمية فسيولوجية حيث أنها تشارك في عملية التمثيل الغذائي للكربوهيدرات ، حيث أنه عندما تزيد نسبة الجلوكوز في الدم عن 120 ملي جرام يخزن الزائد في الكبد والعضلات على هيئة جليكوجين أو نشا حيواني وتتم عملية تحويل الجلوكوز إلى جليكوجين في وجود ATP أو ما يسمى ادينوسين ثلاثي الفوسفات وأيضاً في وجود انزيم يدعى فوسفو جلوكو كينيز وكذلك الأنسولين ، وعندما يقل الجلوكوز في الدم عن المعدل المذكور يتم تحويل الجليكوجين المخزن في الكبد إلى جلوكوز 6 وفوسفات ثمم في وجود انزيم فوسفاتيز الكبد يتحول إلى جلوكوز يسري في الدم ، أما إذا نفد الجليكوجين المخزن في الكبد أيضاً يتم تحويل الجليكوجين المخزن في العضلات إلى جلوكوز 6, فوسفات ثم إلى فركتوز 6,فوسفات ثم إلى فركتوز 1,6, ثنائي فوسفات ثم جزيء ترايوز فوسفات ثم إلى حمض بيروفيك ثم إلى جزيء لاكتوز. من أنشط الذرات في جزيء الجلوكوز هي ذرة الكربون رقم 1 حيث من الممكن أن تستبدل هذه الذرة بمجموعة ميثيل لتكوين ما يعرف بالجليكو سيدات التي لها أهمية دوائية كبيرة وتنقسم الجليكو سيدات إلى : 1. سابونين : يعمل على تقليل قوة التوتر السطحي ويستخدم كمستحلب. 2. ساليسين : وظيفته كمضاد للآلام الروماتيزمية وتخفيض درجة الحرارة. 3. ديجيتوكسين : يعتبر من منشطات عضلة القلب. 4. فلوروديزين : يعمل على زيادة نفاذية الأنيبيبات الكلوية للجلوكوز ليهرب إلى المسام. |
أكسدة الجلوكوز
تتأكسد ذرة الكربون رقم 1 لتصبح حمض الجلوكونيك ، أو قد تتأكسد ذرة الكربون رقم 6 وتعطي جلوكيورونيك ، وهذان الحمضان ينتموا إلى عائلة أحماض اليورونيك والتي تسمى بنوازع السموم الطبيعية. ويوجد حمض الجلوكيورونيك - ومصدره الميوسين بمخاط اللعاب - في بعض الأنسجة وفائدته أنه يتحد مع بعض المركبات مثل المورفين والفينول الناتج من التعفن ليكون مركب يعرف بحمض فينيل جلوكيورونيك الذي يفرز مع البول. ثالثاَ : إدخال مجموعة أمين NH3 : تدخل مجموعة الأمين على ذرة الكربون رقم 2 ، ومن الممكن ان يتم استبدال ذرة هيدروجين مجموعة الأمين بمجموعة الاستيلCOCH3 لتعطي مركب أسيتيل جلوكوز أمين الذي يدخل في تكوين الكيتين بالهيكل الخارجي للمفصليات وبعض القشريات كالجمبري وبعض الحشرات كالخنافس. |
الفركتوز أو سكر الفاكهة ( fructose أو levulose) هو السكر الذي يتكون داخل كل أنواع الفواكه تقريباً وبعض الخضروات. ودرجة تحليته ضعف درجة السكروز أو سكر القصب ، ويستخدم في تحلية الحلويات والمربيات والجيلي والمشروبات الخفيفة والعصائر، كما أنه مصدر حلاوة العسل، ويعطي المذاق نفسه الذي يعطيه السكروز، ولكن الفركتوز أقل من السكروز في إنتاج السعرات الحرارية؛ ولذلك يستخدم في تحلية أطعمة النظام المستخدم لانقاص الوزن. والفركتوز هو الذي يعطي الآيس كريم والحلوى الملمس الناعم، كما أنه يمتص الرطوبة بسهولة فيساعد على طزاجة المخبوزات فلا يتغير طعمها بمرور الوقت.
ولأغراض التجارة، ينتج الفركتوز على هيئة سائل أو بودرة أو أقراص. ويستخدم صانعو الأطعمة الفركتوز المستخرج من الذرة، بصفة أساسية، وفي صورة شراب. وجوده بجسم الحيوان : يوجد في الأماكن التالية : 1- في السائل المنوي 2- في دم أجنة الحيوانات المجترة 3- قد يوجد نادراً في البول وإن وجد يكون بسبب عيب في التمثيل الغذائي للكبد ومن تفاعلاته : أنه يتفاعل ككحول مع الأحماض مثل حمض الفوسفوريك H3PO4 لتكوين استرات الاحماض وهذا الاستر هو مركب وسيط في عملية التمثيل الغذائي للكربوهيدرات وينتج مركبات مثل فركتوز 1 فوسفات ، فركتوز 6 فوسفات ، فركتوز 1،6 فوسفات  |
للاكتوز أو سكر الحليب (بالإنجليزية: Lactose) عبارة عن سكر ثنائي ناتج عن اتحاد وحدة من الجالكتوز و أخرى من الغلوكوز. سكر الحليب يتواجد بشكل طبيعي في الحليب و يشكل ما بين 1.5% و 8% من وزن الحليب. يمكن استخراجه من جوامد الحليب (بكلا صنفيها, جوامد الحليب الحلوة و جوامد الحليب الحامضة) التي تتبقى بعد تصنيع الجبنة.
اللاكتوز سكر ثنائي، صيغته الجزيئية هي C12H22O11 و كثلته المولية هي 342.30غ/مول. يتكون اللاكتوز بعد اتحاد وحدة من الجالكتوز(Gal) و وحدة من الغلوكوز(Glc) برابطة من نوع(β(1→4. إسمه الرسمي هو D-β-جالكتوبيرانوزيل (1->4) D-β-غلوكوبيرانوز و يرمز له برمز Gal-Glc. يمكن استخراج اللاكتوز بواسطة تبخير شرش الحليب (جوامد الحليب) الذي يتم الحصول عليه عن طريق فصل المواد الدهنية و ترسيب الكازين. فنحصل على حبيبات الاكتوز المميه (C12H22O11·H2O) تلك الحبيبات تفقد ماءها بعد تسخنها عند 140 °C . ينصهر اللاكتوز في درجة حرارة تساوي 223 °C و تبلغ انحلاليته بالماء 1,525غ/سم³ اللاكتوز سكر مختزل، لأنه يملك وظيفة نصف أسيتيلية. تتم حلمهة اللاكتوز في الجسم الحي بواسطة أنزيم اللاكتاز حيث يحوله إلى جزيئة من الغلوكوز و أخرى من الجالكتوز (1مول من اللاكتوز--> 1مول من الغلوكوز+ 1مول من الجالكتوز). اللاكتوز عنصر مهم في تغدية صغار الثدييات، ويتم عادة إضافته لطعام الرضع. و يستعمل أيضا في تحضير اللاكتولوز  |
الجالاكتوز ( Galactose) (يسمى بسكر العقل) هو نوع من السكر لا تصل درجة حلاوته إلى الجلوكوز، وهو غير جيد الذوبان في الماء.
يمكن استخراجه من منتجات الالبان المختلفة، من سكر البنجر(الشمندر) ومن الاصماغ المختلفة. يمكن تصنيعه داخل الجسم والذي يشكل جزء من الليبيدات السكرية والبروتينات السكرية في انسجة متعددة. يشكل الجالاكتوز إحدى الوحدتين أحادية السكر في اللاكتوز بينما يشكل الجلوكوز الوحدة الأخرى، يتم تحويل اللاكتوز إلى جلوكوز وجالاكتوز عن طريق الانزيم لاكتيز(lactase)، في جسم الإنسان يتم تحويل الجلوكوز إلى جالاكتوز لافراز اللاكتوز عن طريق الغدد اللبنية. من تفاعلاته:أن يتحد مع جزيء جلوكوز ويكون سكر اللاكتوز "سكر اللبن " وهو سكر ثنائي أيضاً يتحد مع الليبيدات أو الدهون مكوناً جالاكتوليبيدات وهذه المركبات المتكونة الاخيرة تعتبر إحدى مكونات النسيج المخ الشوكي |
المالتوز أو سكر الشعير (بالإنجليزية: Maltose) عبارة عن سكر ثنائي ناتج عن اتحاد وحدتين من الغلوكوز
المالتور سكر ثنائي، صيغته الجزيئية هي C12H22O11 و كثلته المولية هي 342.296غ/مول. يتكون المالتوز بعد اتحاد وحدتين من الغلوكوز برابطة من نوع(α(1→4 لذا فقد يطلق عليه أحيانا اسم ثنائي الغلوكوز. يعتبر المالتوز ثاني مركب من سلسلة بيوكميائية مهمة من الغلوكوز، حيث عند إضافة وحدة غلوكوز أخرى للمالتوز يصبح مالتريوز، ثم مالتتروز إلى آخره. تسمى أحيانا الجزيئات ذاة سلسلة طويلة من الغلوكوز بمتعددة المالتوز. ينتج المالتوز عن حلمهة أنزيمية للنشا بواسطة الأميلاز. ينصهر المالتوز في درجة حرارة تتراوح بين 102 °C و103 °C و تبلغ انحلاليته بالماء 1.080غ/سم³ المالتوز سكر مختزل، أي أن واحد من غلوكوزي المالتوز يملك نهاية مختزلة. الرابطة بين الكربون C1 و C4 غلوكوزية قابلة للحلمهة في وسط حمضي بواسطة أنزيم الهيدرولاز. للماتوز طعم حلو، نصف حلاوة الجلوكوز و خٌمس حلاوة الفركتوز تتم حلمهة المالتوز في الجسم الحي بواسطة أنزيم المالتاز حيث يحوله إلى جزيئتي غلوكوز (1مول من المالتوز--> 2مول من الغلوكوز). للحصول على نفس النتيجة في المختبرات يتم كسر الروابط بواسطة حمض قوي. |
الحمض ( Acid) (يمثل عادة بالصيغة HA) هو أي مركب كيميائي، يكون عند انحلاله في الماء قادرا على تحرير شاردة الهيدروجين (البروتونات)(التي يرمز لها بذرات هيدروجين ذات شحنة إيجابية واحدة أو +1).
عرفت الحموض في البداية بحسب خواصها العامة. فقد كانت موادا ذات طعم لاذع، تحل العديد من المعادن، وتتفاعل من القلويات (أو القواعد) لتكون الأملاح. لقد اعتقد لبعض الوقت، وبعد أعمال لافوازييه، أن المكون العام في جميع الحموض هو عنصر الأكسيجين، ولكن أصبح من الواضح تدريجيا أنه إذا كان هناك عنصرا أساسيا، فهو الهيدروجين وليس الأوكسجين. إن تعريف الحمض حقيقة صاغه ليبيغ في عام 1840 م، فقال "الحمض هو المادة الحاوية على الهيدروجين والتي من شأنها أن تولد غاز الهيدروجين عند تفاعلها مع المعادن". وقد بقي هذا التعريف مرضٍ نحو 50 عاما. هذا التعريف يقارب التعريف الحديث لبرونستد و مارتن لوري، اللذان عرفا على وجه منفصل الحمض كمركب يعطي شاردة الهيدروجين (H+) لمركب آخر (يسمى قاعدة أو أساس). وكمثال معروف عن الحموض، حمض الخل (الموجود في الخل) و حمض الكبريت (الموجود في بطارية السيارة). تختلف أنظمة حمض/قاعدة عن تفاعلات أكسدة-اختزال حيث لا تتغير حالة الأكسدة. |
وتعرف المركبات أو المواد الكيميائية أنها حمضية إذا كان لها صفات الحمض.
في الماء النقي توجد معظم الجزيئات كـ H2O، ولكن عددا صغيرا من الجزيئات تنحل على وجه ثابت وتعود فتتحد. فالماء النقى معتدل مقارنة مع الحموضة أو القلوية لأن تركيز شوارد الهيدروكسيد متساوية دائما مع تركيز شوارد الهيدرونيوم. فالمادة القاعدية في نظر أرينوس هي أي جزيء يزيد من تركيز شاردة الهيدروكسيد عند انحلاله في الماء. لاحظ أن الكيميائيين يكتبون غالبا H+(aq) ويشيرون إلى شاردة الهيدروجين عندما يصفون تفاعل حمض-قاعدة لكن نواة الهيدورجين الحرة، البروتون، غير موجودة وحيدة في الماء، فهي توجد كشاردة الهيدرونيوم H3O+. ومع أن مفهوم أرينوس كان مفيدا في توصيف العديد من التفاعلات، إلا أنه محدود الرؤية. ففي عام 1923، قام الكيميائيان يوهانس برونستد وتوماس مارتن لوري على وجه متفرق بتمييز تفاعلات حمض-قاعدة متضمنة مفهوم انتقال البروتون. وحمض برونستد-لوري (أو ببساطة حمض برونستد) هو صنف يعطي البروتون لأساس برونستد-لوري. إن لنظرية برونستد لوري حمض-قاعدة مزايا عديدة مقارنة بنظرية أرينوس. لنفرض المثال التالي لتفاعلات حمض الخل (CH3COOH)، أحد الحموض العضوية، الذي يعطي الخل طعمه المميز.  |
وتعرف المركبات أو المواد الكيميائية أنها حمضية إذا كان لها صفات الحمض.
في الماء النقي توجد معظم الجزيئات كـ H2O، ولكن عددا صغيرا من الجزيئات تنحل على وجه ثابت وتعود فتتحد. فالماء النقى معتدل مقارنة مع الحموضة أو القلوية لأن تركيز شوارد الهيدروكسيد متساوية دائما مع تركيز شوارد الهيدرونيوم. فالمادة القاعدية في نظر أرينوس هي أي جزيء يزيد من تركيز شاردة الهيدروكسيد عند انحلاله في الماء. لاحظ أن الكيميائيين يكتبون غالبا H+(aq) ويشيرون إلى شاردة الهيدروجين عندما يصفون تفاعل حمض-قاعدة لكن نواة الهيدورجين الحرة، البروتون، غير موجودة وحيدة في الماء، فهي توجد كشاردة الهيدرونيوم H3O+. ومع أن مفهوم أرينوس كان مفيدا في توصيف العديد من التفاعلات، إلا أنه محدود الرؤية. ففي عام 1923، قام الكيميائيان يوهانس برونستد وتوماس مارتن لوري على وجه متفرق بتمييز تفاعلات حمض-قاعدة متضمنة مفهوم انتقال البروتون. وحمض برونستد-لوري (أو ببساطة حمض برونستد) هو صنف يعطي البروتون لأساس برونستد-لوري. إن لنظرية برونستد لوري حمض-قاعدة مزايا عديدة مقارنة بنظرية أرينوس. لنفرض المثال التالي لتفاعلات حمض الخل (CH3COOH)، أحد الحموض العضوية، الذي يعطي الخل طعمه المميز.  |
تصف كلتا النظريتان ببساطة التفاعل الأول: يتصرف CH3COOH كحمض أرينوس لأنه يتصرف كمصدر H3O+ عندما ينحل في الماء، ويتصرف كحمض برونستد بإعطائه بروتون إلى الماء. في المثال الثاني يتعرض CH3COOH للتحول نفسه، فهو يعطي بروتونا إلى الأمونيا (NH3)، ولكن لا يمكن وصفه باستخدام تعريف أرينوس للحمض لأن التفاعل لا يعطي الهيدرونيوم. يمكن أن تصف نظرية برونستد-لوري أيضا جزيءالمركبات الجريئية، بينما توجب نظرية أرينوس على المركب أن يكون أيونيا. يرتبط حمض كلور الماء والأمونياك تحت شروط متعددة ليشكلا النشادر NH4Cl. يتصرف المحلول المائي لحمض كلور الماء كالحمض ذاته، ويكون كشوارد الهيدرونيوم والكلور. التفاعل التالي يوضح محدودية تعريف أرينوس
H3O+(aq) + Cl-(aq) + NH3 → Cl-(aq) + NH4+(aq) HCl(benzene) + NH3(benzene) → NH4Cl(s) HCl(g) + NH3(g) → NH4Cl(s وكما كانت الحالة في تفاعلات حمض الخل، فإن كلا التعريفين صالحان للمثال الأول، حيث يكون الماء هو المذيب و تتشكل شاردة الهيدرونيوم. التفاعلان التاليان لا يشملان تشكل شوارد ولكنهما يبقيان تفاعلان لانتقال البروتون. في التفاعل الثاني يتفاعل حمض كلور الماء مع الأمونياك ليشكلا النشادر الصلب في البنزين كمذيب و في الثالثة يتفاعل حمض كلور الماء والأمونياك NH3 ليشكلا النشادر الصلب. |
| الساعة بإيدك هلق يا سيدي 04:19 (بحسب عمك غرينتش الكبير +3) |
Powered by vBulletin® Copyright ©2000 - 2024, Jelsoft Enterprises Ltd.
ما بخفيك.. في قسم لا بأس به من الحقوق محفوظة، بس كمان من شان الحق والباطل في جزء مالنا علاقة فيه ولا محفوظ ولا من يحزنون