
 |
اقترح جيلبرت نيوتن لويس مفهوما ثالثا يتضمن تفاعلات ذات خصائص حمض-قاعدة والتي لا تتضمن انتقالا للبروتون. حمض لويس هو صنف يقبل زوج من الإلكترونات من صنف آخر لتشكل رابطة تساهمية، وبكلمة أخرى، قابل لزوج إلكتروني.
ومع أنها لم تكن أكثر النظريات عمومية، فإن تعريف برونستد لوري هو أكثر التعاريف استخداما. يمكن فهم قوة الحمض باستخدام هذا التعريف على أنها استقرار الهيدرونيوم والقاعدة المشتقة المنحلة خلال التفكك. ازدياد أن نقصان استقرار القاعدة المشتقة سيزيد أو ينقص حموضة المركب. يستخدم مفهوم الحموضة هذا في الحموض العضوية مثل الحموض الكربوكسيلية. ففي وصف الجزيء المداري (molecular orbital description)، حيث يتداخل مدار البروتون الفارغ مع زوج منعزل، يرتبط بتعريف لويس. هنالك أنواع عديدة من الحوامض, منها ما هو طبيعي كالموجود في الليمون مثلا و منها ما يصنع في المصانع أو المختبرات كحمض كلور الماء (HCl) أو كحمض الكبريت (H2SO4). وأما الرقم الهيدروجيني (بالإنكليزية: "pH" ) فهو بين 0 و 14. |
بالنسبة لوسائل قياس الحموضة فهي متعددة, منها ما هو غير دقيق كالمشعرات (عباد الشمس) ويتغير لونها ودرجة اللون فيها حسب نسبة الحموضة الموجودة بالمحلول. حيث يدل اللون الأخضر على قلوية خفيفة واللون الأزرق على قلوية عالية نتيجة لتصاعد تركيز الانيونات OH- وتكون قيمة ال pH أعلى من 7.
في حين يدل اللون البرتقالي على حموضة خفيفة واللون الاحمر على حموضة عالية نتيجة تصاعد تركيز الكاتيونات H+ وتكون قيمة ال pH أدنى من 7. وهنالك مقاييس الباهاء التي تمتلك جهاز رصد إلكتروني يعطينا نسبة الحموضة مباشرة بعد وضعه بالمحلول الكيميائي، وتحتاج هذه المقاييس إلى معايرة باستعمال محلول ذو باهاء معياري مثل 4 و 7 و 10. وهذه السوائل المعيارية هي محاليل منظمة يمكن شرائها أو تصنيعها |
* ذو طعم حامض.
* تعطي الحموض المركزة أو القوية شعور لاذع في الغشاء المخاطي. * تغير ألوان مشعر الباهاء كالآتي: تصبح ورقة عباد الشمس حمراء، والمتيل البرتقالي يصبح أحمراً، ويصبح الفينول فتالئين عديم اللون. * يتفاعل مع المعادن ليعطي أملاح المعادن و الهيدروجين. * يتفاعل مع كربونات المعادن ليعطي الماء، وثاني أكسيد الكربون، وملح. * يتفاعل مع الأسس ليعطي ماء وملح. * يتفاعل مع أكاسيد المعادن ليعطي ماء وملح. * ناقل للكهرباء بحسب درجة إنحلاله. * يعطي شوارد الهيدرونيوم في الماء [H3O+]. الحموض القوية والعديد من الحموض المركزة هي مواد آكلة، وقد تكون خطيرة، وتسبب حروقاً خطيرة حتى ولو كان التماس بسيطا. تعالج الحروق الناتجة عن الحموض عادة بغسلها بالماء الجاري بغزارة، يتبعها معالجة طبية مباشرة. وفي حالة الحموض المعدنية المركزة جدا كحمض الكبريت أو حمض الآزوت، فيجب أولا تنظيف الإصابة قبل الغسل بالماء، لأن مزج الحموض بالماء هو تفاعل ناشر للحرارة مما يسبب حرق حراري أيضا. |
الدهنيات أو الشحميات Lipids اسم يستخدم للدلالة على مجموعة كبيرة من المركبات احيانا تشمل كل ما هو غير ذواب بالماء أو ما يمكن اعتباره موادا غير قطبية ذات أصل عضوي : بما في ذلك المواد الشمعية waxes و الحموض الدسمة Fattyacids و مشتقاتها من دسم فوسفورية أو سفينغوليبيد أو دسم سكرية أو تربينات و حتى الرتينوئيدات و الستيروئيدات .
هناك تنوع كبير في بنية هذه المركبات فبعضها حلقي ألكاني و بعضها عطري ، بعضها مرن متحرك في حين بعضها الآخر ذو بنية ثابتة الأحماض الدهنية أو الأحماض الدسمة عبارة عن أحماض كربوكسيلية لديها سلسلة أساسية أليفاتية طويلة وغير متفرعة، والتي يمكن أن تكون إما مشبعة أو غير مشبعة. يمكن اعتبار الأحماض الكربوكسيلية ذات سلسلة قصيرة مثل حمض البوتيريك (حمض الزبدة) (4 ذرات كربون) كحمض دهني، في حين أن الأحماض الدهنية المشتقة من الدهون و الزيوت الطبيعية تحوي غالبا على الأقل 8 ذرات كربون، مثل حمض الكابريليك (حمض الأوكتانويك). تكون أغلب الأحماض الدهنية الطبيعية على عدد زوجي من ذرات الكربون، لأن الاصطناع الحيوي لها يتضمن أسيتيل التميم أ Acetyl-CoA الذي هو عبارة عن تميم Coenzyme يحمل مجموعة (زمرة) لها ذرتي كربون. يتم تحضير الأحماض الدهنية صناعيا بحلمهة روابط الإستر في الدهون أو الزيوت الطبيعية والتي تكون عبارة عن غليسيريدات ثلاثية، حيث ينتج الغليسيرين كناتج ثانوي. |
موليبدات الصوديوم مركب كيميائي له الصيغة Na2MoO4 ، ويكون على شكل بلورات بيضاء. كما يوجد على شكل ثنائي هيدرات Na2MoO4.2H2O
* مركب موليبدات الصوديوم منحل في الماء. * يتفاعل مع بورهيدريد الصوديوم ليعطي أكسيد للموليبدنوم ذا حالة أكسدة أدنى Na2MoO4 + NaBH4 + 2H2O → NaBO2 + MoO2 + 2NaOH+ 3H2 يحضر مركب موليبدات الصوديوم من تفاعل حل أكسيد الموليبدنوم السداسي في هيدروكسيد الصوديوم ما بين 50 - 70 °س، ثم بإجراء عملية تبلور للمحلول الناتج MoO3 + 2NaOH → Na2MoO4·2H2O - يستخدم في الكيمياء التحليلية للكشف عن أشباه القلويات، وأيضاً للتمييز بين الأنتيموان والقصدير. - يستخدم في الصناعة ضمن مجال مضادات التآكل. |
ثنائي كرومات الصوديوم هو مركب كيميائي له الصيغة Na2Cr2O7 ، ويكون على شكل بلورات برتقالية، تحوي في بنيتها البلورية على جزيئتي ماء Na2Cr2O7.H2O
* يفقد المركب جزيئتي الماء عند التسخين فوق 100°س . * ينحل مركب كرومات الصوديوم بشكل جيد جداً بالماء حوالي 230 غ / 100 مل ماء عند 20°س. * محاليله في الماء حمضية حيث أن محلول 10% منه له pH مقداره 3.5 . * يمتاز المركب بخواصه المؤكسدة. يحضر ثنائي كرومات الصوديوم ابتداءاً من فلز الكروميت، حيث يلقى في فرن مغلق وتجرى عليه عملية أكسدة قلوية عند حوالي 1000°س، فنحصل على كرومات الصوديوم الذي يسحب من المزيج بحمض الكبريت، فينتج لدينا ثنائي كرومات الصوديوم بالإضافة إلى كبريتات الصوديوم. 4FeO.Cr2O3 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2 2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O يستخدم كمادة مؤكسدة قوية في تفاعلات الاصطناع العضوي. 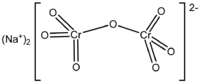 |
الكحول الميثيلي (الميثانول) CH3OH أبسط أنواع الكحوليات تركيباً، وهو يحضر بالتقطير الإتلافي للخشب، لذا يُسمى كحول الخشب (حرق الخشب وتقطره في معزل عن الهواء). وهو واسع الاستخدام كوقود وكمذيب عضوي لكثير من الأغراض وفي صناعة الأحبار والبويات وورنيش الأرضيات، كما يدخل في عملية غش الخمور والكولونيا نظراً لرخص ثمنه بالمقارنة بالكحول الإيثيلي (الإيثانول). الميثانول سائل عديم اللون سريع التطاير في درجة حرارة الغرفة العادية وهو بذاته غير سام ويرجع التأثير السام لنواتج الأيض حيث يتأيض الميثانول إلي مادة شديدة السمية الفورمالدهيد حيث يعتبر 33 مرة أكثر سمية من الميثانول ويتحول الفورمالدهيد بسرعة إلي حمض النمليك خلال 3 دقائق.
الميثانول سريع الامتصاص من الجهاز الهضمي حيث يصل إلي أعلي معدل له في الدم بعد نصف ساعة أوساعة يعتمد علي وجود أوعدم وجود الطعام في المعدة. ويحدث التسمم عادة في فترة تتراوح من 6ساعات إلي ثلاثة أيام وخلال هذه الفترة لا يشتكي الشخص من أي أعراض سمية. وتُعزى النسبة الكبرى من حالات التسمم بالميثانول إلى تعاطيه كبديل للمشروبات الكحولية من قِبَل المدمنين أو من خلال استهلاك خمور جرى غشها بإضافة الميثانول إليها. ويرجع الأثر السام للميثانول إلى تحوله في جسم الإنسان إلى فورمالدهيد وحمض فورميك بواسطة إنزيم نازع هيدروجين الكحول بالكبد يُعد تراكم النواتج الاستقلابية (metabolic products) السامة للميثانول مسئولة عن ظهور أعراض وعلامات التسمم به. وأهم هذه النواتج الفورمالدهيد الذي له تأثير إتلافي على العديد من خلايا الجسم وبخاصة شبكية العين والعصي البصري بالإضافة إلى حدوث الحُماض (acidosis) بسبب تكون حمض الفورميك. وعلى ذلك فأعراض التسمم بالميثانول تبدأ في الظهور بعد فترة تتراوح بين 12 و 14 ساعة من تعاطيه على شكل صداع ودوار وغثيان وقيء وآلام شديدة بالبطن والظهر تعزى إلى التهاب البنكرياس، وتظهر أعراض تثبيط الجهاز العصبي المركزي والفشل التنفسي. ومن العلامات الثابتة للتسمم بالميثانول الاضطراب البصري الذي قد يتراوح ما بين ضعف مؤقت وبسيط بالرؤية وبين حالة العمى التام المصاحب للتعافي من حالات التسمم الحادة حيث تكون الحدقتان متسعتين دون استجابة للضوء 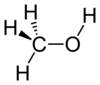 |
الإيثانول مركب كيميائي عضوي ينتمي إلى فصيلة الكحولات له الصيغة C2H5OH. ويسمى كحول الاثانول مادة قابلة للاشتعال عديمة اللون تتكون من تخمر السكر ، يستعمل في المشروبات الكحولية و في صناعة الروائح و يستعمل في بعض الدول في المحركات الميكانيكية المجهزه للاثانول
يصنع الاثانول بطريقتين (1) البتروكيماوية عن طريق التجفيف ال اثيليني و (2) بشكل طبيعي عن طريق تخمير السكر (1)اثيليني مادة خام تستخدم في المصانع مصنعة من مادة بتروكيماوية عادة من حمض منشط . * C2H4 + H2SO4 → CH3 CH2 SO4H * CH3 CH2 SO4H + H2O → CH3CH2OH + H2SO4 (2) التخمير - الاثانول المستعمل في المشروبات الكحولية و معظمه المستعمل في محركات السيارات ذات تقنية تسمح بتشغيل المحرك باالاثانول و أهم نقطة في هذا النظام هو الوصول إلى بكتيريا التعفن للتضاعفها و إنعدام الاكسجين . * C6 H12 O6 → 2 CH3 CH2 OH + 2 CO2 عدا استعماله في مواد التعقيم و المشروبات المسكرة ستعمل كوقود للمحركات ففي البرازيل أكبر مخازن و محطات وقود في العالم تنتج و تستهلك الايثانول كوقود للسيارات و الطائرات ذات الوزن الخفيف و بقرار من الحكومة البرازيلة يجب ان يمزج 25% من الاثنول بكل 1لتر بنزين لتخفيض تكلفته و التقليل من تلوث البترول . اليوم أكثر من 50% من السيارات في البرازيل مجهزة لتعمل على البنزين و الايثانول و يسمى محرك فليكس .  |
البروبان هو مركب كيميائي له الصيغة الكيميائية C3H8. وهو من الألكانات, أى أنه هيدروكربون أليفاتي. ويتم إشتقاقه أحيانا من منتجات النفط خلال تصفية النفط, أو أثناء عمليات تصنيع الغاز الطبيعي
يستخدم البروبان كوقود ويعرف بإسم الغاز النفطي المسال (liquified petroleum gas (LPG or LP gas, ويتم خلطه مع كميات قليلة من بروبيلين, بيوتان, بيوتيلين, إثاننثيول لإعطاء رائحة للبروبان. ويتم استخدامه كوقود في الطبيخ و الشواء, والمواد المتنقلة, وفى السيارات. وفى الحافلات, أوناش الشوكة, سيارات الأجرة, كما يستخدم في المخيمات. وفى المناطق الريفية بالولايات التحدة يستخدم في الأفران, تسخين المياه, المغاسل. ويتم نقل البروبان في صهاريج كبيرة إلى مستودعات دائمة قريبة من مناطق الاستخدام, لمليء أنابيب البروبان. ويستخدم في صناعة التبريد حيث يسمى مبرد إمتصاص الغاز. ولا يزال كثير من المبردات التي صنعت في فترة الثلاثينيات تعمل إلى الآن. يستخدم البروبان أيضا في رش رذاذ وخاصة بعد حظر CFC. ويطلق عليه الغاز الأخضر. ويستخدم في نوع من أنواع المسدسات تسمى مسدسات "أيرسوفت" (airsoft ). كما يستخدم في تصنيع البتروكيماويات السفلى في التكسير البخاري. تم التعرف على البروبان لأول مرة كمكون متطاير من الجاسولين بواسطة والتر أوز سنيلج مكتب المعادن بالولايات المتحدة في عام 1910. وكان أول من قام ببيع البروبان اقتصاديا وأسماه الجاوزل الأمريكي في عام 1912. |
الألكان في الكيمياء العضوية هو هيدروكربون متشبع مؤلف من سلسلة مفتوحة غير حلقية والتي فيها يكون الجزيء به الحد الأقصي من ذرات الهيدروجين وبالتالي لا يكون بها روابط ثنائية.
الألكانات تعرف أيض بإسم برافينات, أو إجمالا "سلسلة البرافينات" وهذه المصطلحات يمكن أن تستخدم أيضا للألكينات والتي تكون ذرات الكربون بها سلسلة أحادية, غير متفرعة, وعند وجود تفرعات في سلسة الألكانات تسمي "أيزوبرافينات" وتنتمى الألكانات للمركبات الأليفاتية. المعادلة العامة لتركيب الألكانات CnH2n+2, وأبسط ألكان على هذا يكون الميثان, CH4, ويليه الإيثان, C2H6, وهكذا. وكل ذرة كربون في الألكانات لها تهجين sp3. يمكن للجزيئات التي تحتوى على أكثر من 3 ذرات كربون أن تترتب بعدة طرق, مكونة أيزومرات عديدة. الألكانات "العادية" لها تركيب خطي, غير متفرع. ويزيد عدد المتماكبات بشدة بزيادة عدد ذرات الكربون, فعدد الأيزومرات للألكانات التي لها من 1 إلى 12 ذرة كربون تكون كالتالي: 1, 1. 1, 2, 3, 5, 9, 18, 35, 75, 159, 355 بالترتيب. |
ينتهى اسم الألكان باللاحقة "ان". الحلقات المستقيمة للألكانات والتي بها 8 أو أقل من ذرات الكربون يتم تسميتها طبقا للجدول التالي, والذى يحتوى أيضا على اسم الألكيل المتكون بنزع ذرة الهيدروجين الطرفية. (لمشاهدة قائمة كاملة للألكانات قائمة ألكانات
ميثان CH4 ميثيل CH3 ايثان C2H6 ايثيل C2H5 بروبان C3H8 بروئيل C3H7 بوتان C4H10 بوتيل C4H9 بنتان C5H12 بنتيل C5H11 هكسان C6H14 هكسيل C6H13 هبتان C7H16 هبتيل C7H15 أوكتان C8H18 اوكتيل C8H17 |
الألكانات المتفرعة يتم تسميتها طبقا للآتى:
1. تحديد أطول سلسلة متصلة لذرات الكربون. 2. ترقيم الذرات بداية من أحد الأطراف حتى الطرف الآخر, على أن يكون طرف البداية هو الأقرب لمجموعات التفرع في حالة وجودها. 3. تحديد المجموعات المتصلة بالسلسلة بالترتيب وبداية كتابة اسم الألكان كالتالي: 1. رقم ذرة الكربون المتصلة بمجموعات فرعية, وفى حالة وجود أكثر من تفرع يتم كتابة أرقام التفرع بترتيب الترقيم في السلسلة الرئيسية ( 3,2- وليس 2,3- . 4,1- وليس 1,4- . وهكذا) 2. في حالة وجود اتصال لنفس المجموعة أكثر من مرة بسلسة الألكان, نستخدم البادئات التالية طبقا لعدد مرات التكرار: " ثنائي", "ثلاثي", "رباعي", وهكذا. 3. اسم المجموعة أو المجموعات المتصلة بالسلسلة, بنفس ترتيبها طبق لترقيم السلسلة. 4. ينتهى الاسم بكتابة اسم أطول سلسلة مستقيمة. ولتنفيذ هذه الخطوات, يجب أن نعرف اسم المجموعات المتصلة بالسلسلة. وهذا يتم بنفس الطريقة السابقة فيما عدا انه يتم ترقيم المجموعة بداية من أول ذرة كربون متصلة بسلسلة الألكان, وفى إتجاه أطول سلسلة بداية من هذه النقطة, وليس طبقا لأطول سلسلة موجودة في المجموعة. فمثلا المركب (1) في الشكل القادم هو الاحتمال الوحيد لوجود تفرع في البيوتان. وإسمه الرسمي 2-ميثيل بروبان, بينما البنتان يمكن أن يكون له 2 متزامر (isomer), بالإضافة إلى شكل سلسلته المستقيمة.الشكل (2) 2,2- ثنائي ميثيل بروبان, الشكل (3) 2-ميثيل بيوتان. |
البينتان يعرف أيضا بإسم أميل هيدريد أو سيكيلي سولف (skellysolve) هو من الهيدروكربونات. كما أن البينتان ألكان له الصيغة الكيميائية CH3(CH2)3CH3. ويوجد للبينتان 3 متزامرات (isomer). وهم إن-بينتان (السلسلة مستقيمة) , أيزوبينتان (2-ميثيل بيوتان) , نيوبينتان وإسمه الرسمي2,2-ثنائي إثيل بروبان.
الإتجاه الفيزيائى لهذه النظائر بالترتيب "إن-, "أيزو-", "نيو-" هي كالتالي: نقطة الغليان 36 C, 28 °C, 9.5 °C, نقطة الذوبان -130 C, -160 °C, -16.6 °C, -16.6 °C. التشكل الكيميائي لـ إن-بينتان يشبه الـ إن-بوتان, وتضيف مجموعات الميثيل الطرفية تداخل بينتان. الهكسان هو من الهيدروكربونات. كما أن الهكسان ألكان له الصيغة الكيميائية CH3(CH2)4CH3. البادئة "هكس" ترجع إلى وجود 6 ذرات كربون, بينما اللاحقة "ان" تدل على أن الرابطة أحادية بين ذرات الكربون. متزامرات (isomer) الهكسان غير نشطة, ولذا غالبا ما تستخدم كمذيب خامل في التفاعلات العضوية لأنها غير قطبية. كما أنهم من المركبات الشائعة في الالجازولين. |
الهيبتان (يعرف أيضا اثنائي ميثيل ميثان, جيتيوسولف-سي, gettysolve-C, هيدريد هيبتيل) هو من الهيدروكربونات. كما أن الهيبتان ألكان له الصيغة الكيميائية CH3(CH2)5CH3. الهيبتان له 9 متزامرات (isomer).
المتزامر إن-هيبتان (السلسلة المستقيمة للهيبتان) تم اختياره كنقطة الصفر في مقياس تقيييم الأوكتان. وهو من المواد الغير مفضل وجودها في الوقود, حيث أنه يحترق بإنفجار, مما يسبب طرقات في محرك السيارة, وعلى العكس, فإن متزامر الأوكتان الذي له سلسلة متفرعة, يتحرق ببطء ويعطي أداء جيد للمحركات. وقد تم اختيار إن-هيبتان كنقطة الصفر نظرا لأنه لإمكانية تواجده في صورة عالية النقاوة, الغير مختلطة بالمتزامرات الأخرى للهيبتان والألكانات الأخرى, ويتم الحصول عليه من راتينج جيفري بين. ويمكن الحصول أيضا على كل من الهيبتان والأوكتان من الزيت الخام, ولكنه يحتوى على خليط من المتزامرات الأخرى بنسب متغيرة, ولذا لا يكون لاستخدامه كنقطة صفر في مقياس الأوكتان الأوكتان هو أحد الألكانات الهيدروكربونية, وله الصيغة البنائية CH3(CH2)6CH3. وله كثير من المتزامرات (isomer). أحد هذه المتزامرات هو أيزو-أوكتان أو 4,2,2-ثلاثي ميثيل البينتان, وهو مركب هام للغاية, في تقييم البنزين (الذى يستخدم في محركات الإحتراق الداخلي في السيارات) حيث أنه يمثل 100 نقطة في مقياس رقم الأوكتان, بينما الهيبتان هو نقطة الصفر. وتقييمات الأوكتان هي تقييمات تستخدم في تمثيل حدوث طرقات في المحرك أثناء استخدام البترول. وكلما قل عدد الاوكتان كلما إحترق الوقود داخل المحرك مبكرا (الأوكتان يسبب حدوث طرقات أقل من الهيبتان). ويتم تقدير هذا الرقم نسبة خلط كل من (4,2,2-ثلاثي ميثيل بينتان), و إنهيبتان). فمثلا 87-أوكتان يعنى أن البنزين سيكون له نفس نشبة طرقات المحرك التي تنشأ عن خليط من 87% أيزو-أوكتان, 13% هيبتان النونان هو أحد الألكانات الهيدروكربونية, وله الصيغة البنائية الآتية : CH3(CH2)6CH3 الديكان هو أحد الألكانات الهيدروكربونية, وله الصيغة البنائية CH3(CH2)8CH3. يوجد للديكان 75 متزامر (isomer), وجميعهم سوائل قابلة للإشتعال. الديكان أحد مكونات البنزين (وقود), ومثل الألكانات الأخرى فإنه غير قطبي وعلى ذلك فإنه لا يذوب في السوائل القطبية مثل الماء. |
التقطير تقنية هدفها فصل مواد كيميائية عن بعضها البعض اعتمادا على اختلاف درجة غليانها فنحصل على قطارة من جهة وحثالة من جهة أخرى.
تتمثل عملية التقطير المائي في تبخير خليط غير متجانس مكون من الماء ومادة طبيعية يليه تكثيف البخار بتبريده للحصول على نكهات أو روح عطر. والتقطير أنواع: * التقطير البسيط أو التدريجي. * التقطير الفجائي الاتزاتي (flash). * التقطير المتكرر باستعمال أبراج التقطير. * التقطير ببخار الماء. * الامتصاص (المادة). التقطير عو عملية لفصل المواد بوساطة الحرارة . وهي لا تحتاج غلى إضافات أخرى أو مذيبات أو كيماويات . وتعتمد الطريقة على فروق في درجة غليان السوائل المراد فصلها . ويسمي الكيميائيون هذا الفرق فرق الضغط البخاري للمواد عند درجة حرارة معينة . وكما بالشكل المجاور : عندما نقوم بتسخين مخلوط السوائل 1 (ودرجة غليانه منخفضة) والسائل 2 (درجة غليانه مرتفعة)، وليكن نسبة المخلوط الابتدائية نحو 1و0 (أي 10 % (السهم الأزرق الرأسي)) . فترتفع درجة حرارة المخلوط إلى أن تصل منحنى الغليان (منحنى السائل باللون الأزرق ). ويتكون البخار الناتج فوق السائل المغلي غنيا ببخار السائل ذو درجة غليان منخفضة، وفقيرا بالنسبة لبخار السائل ذو درجة غليان مرتفعة (تابع السهم الأفقي من اليسار إلى اليمين عند درجة حرارة ثابتة ، حيث يلتقي بمنحنى البخار (الخط الأحمر)) . و يلتقي السهم بمنحنى البخار عند نسبة 6و0 (أي أن نسبة السائل المراد تنقيته في البخار أصبحت 60 % ) . وعند تكثيف البخار نحصل على سائل يساوي في نسبته نسبة السائلين في البخار. بذلك يصبح السائل الناتج غنيا بالسائل ذو درجة غليان منخفضة . ويلاحظ أنه مع مرور الوقت تقل نسبة السائل (الطيّار) إلى السائل ذو درجة غليان عالية في قارورة الغليان . |
التقطير التسلسلي متعدد المراحل
بتكرير عملية التقطير مع السائل الناتج من العملية الأولى يمكننا رفع نسبة السائل ذو درجة غلايان منخفضة إلى السائل ذو درجة غليان عالية . ويمكن إجراء ذلك في جهاز يحتوي على عدة أجهزة تقطير متتالية . وبذلك نقترب تدريجيا إلى فصل تام للسائلين . التقطير بالأنبوب القصير ويتحقق ذلك عمليا ببناء مجموعة من أجهزة التقطير تتلو الواحدة الأخرى في سلسلة متتالية ، ويحدث ذلك في مصفاة البترول هذا الجهاز يعمل عند ضغوط منخفضة بين 1 ضغط جوي و 001و0 ضغط جوي ، ويتميز بالمحافظة على التركيب الكيميائي للسوائل حيث تجرى عملية التقطير عند درجة حرارة منخفضة . وبتخفيض الضغط تنخفض تبعا درجة غليان السوائل . وهذه الطريقة تصلح أيضا للاستخدام لفصل الجزيئات العضوية المتسلسلة الطويلة واستخلاصها من نفايات الصناعات البترولية. (1)السوائل المراد تقطيرها، تُسخن القارورة قليلا. (2) نظام أنبوبي قصير ، ويحتوي على أنبوب داخلي معوج قليلا فينزلق السائل المتكثف عليه إلى قارورة السائل المقطر . (3) مدخل ماء التبريد . (4) مخرج ماء التبريد . (5) توصيلة الهواء المخلخل .(6 ) قارورة السائل المقطر ، وتحفظ باردة .  |
التبلور (أو البَلْوَرَة) عبارة عن عملية تشكيل (طبيعية كانت أم اصطناعية) للبلورات الصلبة من المحلول.
تعد عملية التبلور أيضاً من تقنيات الفصل في الجمل الصلبة-السائلة، حيث تحدث عملية انتقال للكتلة للمادة المنحلة من طور المحلول السائل إلى الطور البلوري الصلب والنقي. التسامي أو التصَعُّد (Sublimation) هو تحول المادة من الحالة الصلبة إلى الحالة الغازية دون المرور بالحالة السائلة. يحدث في التسامي تغير لطور المادة والذي يحدث عند درجات حرارة وضغوط أقل من النقطة الثلاثية في مخطط طور المادة. عند الضغوط النظامية تمتلك معظم العناصر والمركبات الكيميائية ثلاث حالات مختلفة عند درجات حرارة مختلفة، تكون الحالة السائلة هي المرحلة الوسط بين الحالة الصللبة والحالة الغازية. لكن بعض العناصر والمواد تتجاوز الحالة السائلة عند التحول من صلب إلى غاز. تسمى درجة الحرارة التي يحدث عندها هذا التحول بدرجة حرارة التسامي، والضغط كذلك بضغط التسامي، ويشار إلى كليهما بمصطلح نقطة التسامي |
* توجد العديد من المواد التي تتسامى عند ضغوط منخفضة، بالتاي تسبب مشاكل في التطبيقات التي تتطلب تفريغ عال مثل الزنك والكادميوم.
* يعد الثلج الجاف، وهو الشكل الصلب من ثنائي أكسيد الكربون، من أكثر الأمثلة شيوعاً . كذلك اليود مثال شائع أيضاً على هذه الحالة، حيث يتسامى بأبخرته عند يسخينه قليلا ، كما يمكن انصهار اليود تحت الضغط الجوي العادي فوق نقطة انصهار اليود بقليل. تستخدم هذه الظاهرة في التجفيف بالتجميد، والتي تمكن من تعليق الملابس المبتلة خارجاً في الطقس المتجمد فتصبح جافة مرة أخرى. * يتسامى النفثالين بسهولة ولذلك يستخدم لمكافحة العت (كرات النفثالين)، كما يتسامى الزرنيخ عند درجات حرارة مرتفعة. * البعض من المركبات الكيميائية يتسامى أيضاً، مثل كلوريد الأمونيوم، الذي يؤدي تسخينه إلى تفككه إلى كل من كلوريد الهيدروجين والأمونياك في تفاعل عكوس. NH4Cl → HCl + NH3 * تتسامى بعض البوليمرات أيضاً مثل الكيفلر |
الترشيح (: Filtration): أو التصفية هي عملية ميكانيكية أو فيزيائية تستخدم لفصل المواد الصلبة من الموائع (سوائل أو غازات) وذلك بوضع أداة (مرشح) تسمح للمائع بالتدفق والمرور خلالها، ولكن لا تسمح للمواد الصلبة (أو على الأقل جزء من المواد الصلبة) بالمرور. ويجب التأكيد على أن عملية الترشيح ليست كاملة، وتعتمد على حجم المسام وسماكة المرشح فضلا عن آليات الترشيح. و يستخدم الترشيح لتنقية الموائع. فعلى سبيل المثال، فصل الغبار من الجو لتنظيف الهواء المحيط. وعملية الترشيح، بوصفها عملية فيزيائية، مهمة جدًا في الكيمياء لفصل المواد ذات التركيب الكيميائي المختلف في المحلول (أو المواد الصلبة التي يمكن حلها) حيث يتم استخدام أولا مادة تتفاعل لترسيب إحدى المواد وبعدها يستخدم المرشح لفصل المادة الصلبة من المواد الأخرى. والترشيح عملية مهمة أيضًا وتستخدم بشكل واسع كعملية أساسية في الهندسة الكيميائية. ويجب الانتباه إلى عدم الخلط بين الترشيح و الغربلة ( sieving). ففي الغربلة يوجد طبقة وحيدة فقط للمنخل، حيث تحدث الغربلة بحسب حجم جزيئات المواد الصلبة بحيث لا يمكن للجزيئات الكبيرة أن تمر من ثقوب المنخل (انظر توزع أحجم الجسيمات(particle size distribution)). أما في الترشيح، فيتم استخدام مرشح متعدد الطبقات، وتعتمد عملية الترشيح على آليات مختلفة، مثل الاعتراض المباشر، والانتشار وفعل القوة النابذة، حيث تعلق الجزيئات غير القادرة على اتباع المجاري المتعرجة في المرشح. |
واعتمادًا على هذا التطبيق، يمكن عزل إما أحد المركبين أو كلاهما. وتشمل الأمثلة على عملية الترشيح
* مرشح القهوة لإبقاء القهوة منفصلة عن الرواسب. * استخدام مرشحات (HEPA : High Efficiency Air Particulate) في تكييف الهواء لإزالة الجسيمات من الهواء. تفصل عملية الترشيح بين الجسيمات والمائع من المحلول المعلق، ويمكن للمائع أو الغاز (أو الموائع فوق الحرجة). و لفصل مزيج من المركبات الكيميائية، يتم اختيار مذيب قادر على حل المكون الأول، وغير قادر على حل المكون الثاني. يتم بعدها ترشيح المحلول، فيمر عندها العنصر الأول خلال المرشح، فيما يبقى العنصر الآخر. وهذه واحدة من أهم التقنيات التي يستخدمها الكيميائيون لتنقية المركبات. ويستخدم الترشيح لتنظيف تيارات الهواء أو تيارات الغازات الأخرى. وتستخدم المرشحات في الأفران لمنع العناصر المنطلقة من الوصول إلى الجو. كما تستخدم المرشحات في أنظمة النقل الهوائية لترشيح أو إيقاف أو تبطيء جريان المواد المنقولة، من خلال استخدام مرشح كيسي (baghouse). |
ملغمة ( Amalgam) وهي خليطة أي معدن مع الزئبق، أو بشكل آخر هي محاليل المعادن في الزئبق؛ حيث أنه المعدن الوحيد في الحالة السائلة عند الشروط النظامية وله القدرة على حل المعادن الأخرى مثل الصوديوم، البوتاسيوم، الزنك، الكادميوم، القصدير، الرصاص، الفضة، والذهب وذلك باستثناء الحديد و النيكل مما يمكن من حفظ الملغمة بأواني مصنوعة منهما يمكن أن تتشكل الملغمة بشكل ماص للحرارة مثل معدن القصدير، إلا أنه في الغالب يكون التشكل ناشر للحرارة.على سبيل المثال ينحل الصوديوم في الزئبق وذلك مع نشوء ألسنة اللهب. تكون الملغمة سائلة إلى صلبة وذلك حسب محتوى المعدن فيها، حيث تكون الصلبة منها في حالة لدنة في البداية ثم تتصلب ذاتياً. - تستخدم ملغمة الفضة في حشو الأسنان في مجال طب الأسنان - تتفاعل ملغمة المعادن القلوية مع الماء بشكل بطيء مع تحرير غاز الهيدروجين، لذلك تستخدم كعامل مرجع، مثل ملغمة الصوديوم |
الموائع كجمع لكلمة مائع ( fluids) تشكل مجموعة من أطوار المادة و هي أي مادة قابلة للانسياب تحت تأثير إجهاد القص و تأخذ شكل الإناء الحاوي لها. تتضمن السوائل ، الغازات ، البلاسما و أحيانا الأصلاب اللدنة plastic solids .
تصنف الموائع عادة إلى: * موائع قابلة للانضغاط و هي الموائع التي تتغير كثافتها بتغير الضغط الواقع عليها مثل الغازات و موائع غير قابلة للانضغاط و هي الموائع التي لا تتغير كثافتها بتغير الوضع الواقع عليها مثل السوائل * موائع نيوتنية و موائع غير نيوتنية. المائع النيوتني هو مائع تكون فيه علاقة الإجهاد-الانفعال علاقة خطية أي على شكل مستقيم يمر من مبدأ الإحداثيات، ويعرف اسم ثابت التناسب باللزوجة. سمي هذا المائع على اسم العالم اسحق نيوتن. مائع لا نيوتوني هو مائع لا يمكن وصف جريانه باستخدام ثابت اللزوجة. تعتبر أغلب المحاليل البولميرات والبوليمرات الذائبة من الموائع اللانيوتونية والكثير من السوائل الشائعة مثل الكتشب، ذائب النشا، الدم والشامبو. |
حمض النيتريك أو حمض الآزوت HNO3 هو حمض معدنى قوي، شديد التآكلية، سام، له القدرة على إحداث حروق خطيرة عديم اللون في حالة نقاوته، العينات القديمة يميل لونها إلى الأصفر نتيجة تراكم أكاسيد النيتروجين. اذا كان المحلول يحتوى على أكثر من 86% حمض نيتريك، فإنه يسمى بحمض النيتريك المدخن، حمض النيتريك المدخن يميز كحمض النيتريك المدخن الأبيض و حمض النيتريك المدخن الأحمر على حسب كمية ثانى أكسيد النيتروجين المحتوى عليها. 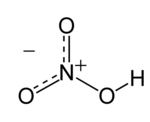 **************** * الشكل ألفا α-HgS وهو ذو لون أحمر قرمزي وهو الشكل الذي يوجد به الزئبق غالباً في الطبيعة. * الشكل بيتا β-HgS وهو ذو لون أسود، وهو الذي ينشأ عند الكشف عن الزئبق بترسيبه على شكل كبريتيد * انحلالية كلي الشكلين من مركب كبريتيد الزئبق الثنائي ضعيفة جداً في الماء. HgS ⇌ Hg up2+ + Sup 2- ...KL = 10up-54 * لا يتفاعل مع الأحماض والقواعد، إلا أنه يتفكك بتفاعله مع الماء الملكي. يوجد مركب كبريتيد الزئبق الثنائي في الطبيعة في معدن الزنجفر Cinnabar. يحضر مركب كبريتيد الزئبق الثنائي مخبرياً من تمرير غاز كبريتيد الهيدروجين في محاليل الزئبق، حيث يترسب الشكل بيتا أسود اللون. * كان يستعمل سابقاً كخضاب للون الأحمر على شكل مسحوق الزنجفر. * يستخدم في تحضير مركبات الزئبق الأخرى. |
الحمض معدنى (Mineral acid) هو أى حمض مشتق من المعادن اللاعضوية عن طريق التفاعلات الكيميائية. الأحماض المعدنية تستخدم كعوامل حفازة وعوامل مساعدة كما في حالة حمض الكبريتيك كمجفف للغازات من الرطوبة(الماء)، وتستعمل أيضاً كعوامل منظفة في صناعة الإلكترونيات.
تتميز الأحماض المعدنية بسهولة ذوبانها في الماء حيث أنها مركبات قطبية، أي أنها متأينة في الماء، ولها شحنات سالبة وموجبة. وتوجد أحماض معدنية ضعيفة مثل حمض الفوسفوريك وأغلبيتها أحماض قوية. معظم الأحماض المعدنية لونها شفاف، رائق ولكن احيانا يتعكر لونها بسبب وجود بعض الشوائب والغازات. أمثلة للأحماض المعدنية: 1. حمض الكبريتيك 2. حمض النيتريك 3. حمض الهيدروكلوريك 4. حمض الفوسفوريك |
المركب الكيميائي حمض الهيدروكلوريك أو حمض كلور الماء ( Hydrochloric acid) هو محلول مائي لغاز كلوريد الهيدروجين HCl وهو حمض معدني قوي، وهو المكون الرئيس لحمض المعدة، وله نطاق استخدام واسع في الصناعة. التعامل مع حمض الهيدروكلوريك يجب أن يتم بحرص شديد مع اتخاذ احتياطات الامان الملائمة حيث أنه سائل شديد التآكلية.
كان لحمض الهيدروكلوريك أو حمض الميوريتك كما كان يسمى قديماً ، أهمية كبيرة منذ قديم الازل. واكتشفه جابر ابن الحيان في حوالي عام 800 م. واستخدم حمض الهيدروكلوريك في العصور الوسطى حيث كان السعي الدؤوب لإيجاد حجر الفيلسوف. ولاحقاً استخدمه العلماء الأوروبيين أمثال جلوبر ودافي وبريستلي ليتعلموا مباديء الكيماء الحديثة. خلال الثورة الصناعية أصبح سلعة كيميائية مهمة للكثير من التطبيقات ، وعلى ذلك إنتاج المركبات العضوية على نطاق واسع ، كإنتاج كلوريد الفينيل لصناعة لدائن بي في سي وال ام دي اي/تي دي اي لصناعة عديد اليوريثان ، وتطبيقات على نطاق صغير مثل إنتاج الجيلاتين ومكونات أخرى في الغذاء ، ومعالجة الجلود. حالياً ، يبلغ إنتاج العالم من غاز كلوريد الهيدروجين مايقارب ال 20 مليون طن. |
عادة عند إنتاج حمض الهيدروكلوريك على نطاق واسع فذلك يتم بتكامل مع إنتاج كيماويات أخرى ، أي يتم إنتاجه على مجال واسع كعنصر يدخل في إنتاج مركبات كيميائية أخرى. في صناعة الكلورقلوي ، يتم تحليل الملح كهربياً وينتج الكلور الحر وكلوريد الصوديوم والهيدروجين. يتم إعادة اتحاد الكلور النقي مع الهيدروجين ويتم تكوين غاز كلوريد الهيدروجين النقي. وذلك التفاعل تفاعل طارد للحرارة.
Cl2 + H2 → 2 HCl غاز كلوريد الهيدروجين الناتج يتم إذابته في ماء منزوع الأيونات حيث ينتج حمض هيدروكلوريك نقي. الاصطناع العضوي يتكامل أكبر إنتاج لحمض الهيدروكلوريك مع صناعة المركبات العضوية المكلورة والمفلورة. وعادة في حالات الإنتاج مثل هذه فإنه يتم إستهلاك الحمض فور تحضيره في نفس مكان اصطناعه حمض الهيدروكلوريك حمض لاعضوي قوي ويستخدم في الكثير من العمليات الصناعية. وعادة مايكون التطبيق هو المحدد لجودة المنتج المطلوب. من تطبيقات حمض الهيدروكلوريك عالي الجودة هو اعادة توليد مبادلات الأيونات الراتنجية. يكون حمض الهيدروكلوريك ضباب حمضي في حالة التركيزات العالية. كلاً من المحلول والضباب لهم تأثير تآكلي على أنسجة الإنسان ، ويدمر أعضاء التنفس والعين والجلد والأمعاء. |
الكلور (من الأصل الإغريقي "خلوروس" χλωρός والذي يعني الأخضر الشاحب) هو عنصر كيميائي له العدد الذري 17، والرمز Cl. وهو من الهالوجينات ويوجد في المجموعة 17 في الجدول الدوري للعناصر. ونظرا لأنه جزء من ملح الطعام ومركبات أخرى، فإنه متوفر طبيعيا، وهام لمعظم أشكال الحياة، بما فيها الجسم البشري. وغاز الكلور أصفر مخضر، وهو أقل كثافة من الهواء بمرة ونصف، وله رائحة كريهة، كما أنه سام للغاية. وهو عامل مؤكسد قوي، مبيض (للأقمشة وما إلى ذلك)، كما أنه عامل مطهر.
الكلور في حالته العنصرية النقية، غاز أصفر مخضر ثنائي الذرة Cl2 وهذا العنصر من سلسلة الهالوجينات المكونة للأملاح، ويتم استخلاص الكلور عن طريق الأكسدة وأيضا بطريقة التحليل الكهربي الشائعة. ويتفاعل الكلور بسرعة تقريبا مع كل العناصر الأخرى. وفي درجة 10° C فإن لتر من الماء يمكن أن يذاب فيه 3.1 لتر من الكلور وفي درجة 30 °C يمكن إذابة 1.77 لتر فقط. الكلور من الكيماويات المهمة في تنقية الماء، مبيد جراثيم، مبيض (للأقمشة وما إلى ذلك)، غاز الخردل. |
يستخدم الكلور في تصنيع كثير من المنتجات التي تستخدم بصفة يومية.
* يستخدم (في شكل حمض تحت الكلور) لقتل البكتريا والأشكال الأخرى من الجراثيم في ماء الشرب وأحواض الاستحمام. وحتى مصادر الماء الصغيرة يتم كلورتها بصفة دورية. * يستخدم بكثرة في المنتجات الورقية، المواد المطهرة، الصبغات، الطعام، مبيد حشرات، الدهانات، منتجات النفط، اللدائن، الطب، الأقمشة، المذيبات، وعديد من المنتجات الاستهلاكية. يتم استخدام الكلور بكثرة في الكيمياء العضوية كعامل مؤكسد وكمجموعة استبدال لأن الكلور غالبا ما ينتج عنه الخصائص المطلوبة للمركبات العضوية عند استبداله للهيدروجين (كما في إنتاج المطاط الصناعي). الاستخدامات الأخرى تتضمن إنتاج الكلورات الكلوروفورم، رباعي كلوريد الكربون، كما يستخدم في إنتاج البروم. الكلور (كلمة إغريقية χλωρος، ، تعني أصفر مخضر) تم اكتشافه عام 1774 م عن طريق كارل وليهلم شيلي، الذي ظن بطريق الخطأ أنه يحتوى على الأكسجين. وتم تسمية الكلور عام 1810 بواسطة همفرى دايفي، الذي أصر في ذلك الوقت أنه عنصر كيميائي يتواجد الكلور في الطبيعة فقط على هيئة أيون كلوريد. وتمثل الكلوريدات حجم كبير من الأملاح الذائبة في المحيطات، تقريبا 1.9 % من كتلة ماء البحر عبارة عن أيونات كلوريد. كما أنه توجد نسب أعلى من أيونات الكلوريد ذائبة في البحر الميت وفي ترسبات الماء شديد الملوحة. معظم الكلوريدات ذائبة في الماء، ولذلك فإن الكلوريدات الصلبة تتواجد في الأماكن ذات المناخ الجاف، أو في عمق الأرض. ومن الأملاح المعروفة للكلور "الهالايت" (كلوريد الصوديوم)، "سيلفايت" (كلوريد البوتاسيوم) ، "كارنالايت" كلوريد بوتاسيوم منجنيز سداسي الهيدرات. وفي الصناعة يتم إنتاج الكلور غالبا بالتحليل الكهربي لكلوريد الصوديوم الذائب في الماء. وينتج مع الكلور في عملية ألكلة الكلور غاز الهيدروجين، هيدروكسيد الصوديوم، طبق للمعادلة الآتية: NaCl + 2 H2O → Cl2 + H2 + 2 NaOH مركبات الكلور تتضمن الكلوريد، الهيبوكلوريتات، الكلوريتات، البيركلورات، كلورامينات |
يوجد نظيران أساسيان وثابت للكلور، ولهما كتلة 35، 37، ويوجدا بنسبة 1:3 على الترتيب، مما يعطى ذرة الكلور في الإجمالي الكتلة 35.5. وللكلور 9 نظائر بكتل تتراوح من 32 إلى 40. ويتواجد 3 فقط من هذه النظائر بصورة طبيعية: النظير Cl-35 (75.77%)، Cl-37 (24.23%)، النظير نشيط إشعاعي Cl-36. نسبة Cl-36 للكلور الثابت في الطبيعة تقريبا تساوي 700*10up-15 إلى 1. ويتم إنتاج Cl-36 في الغلاف الجوي عن طريق تشظي الأرجون-36 بالتفاعل مع بروتونات الأشعة الكونية. وفي الطبقات السفلى للغلاف الجوي يتكون Cl-36 في المقام الأول كنتيجة لأسر النيوترون بواسطة Cl-35 أو عن طريق أسر الميون بواسطة الكالسيوم-40. ويضمحل Cl-36 إلى الكبريت-36 والأرجون-36، وبعمر نصف مشترك يبلغ 308،000 عام. وعمر النصف لهذه النظائر المحبة للماء وغير النشيطة يجعلها مناسبة تحديد زمن جيولوجي في المدى من 60،000 إلى مليون سنة. كما أن الكميات الكبيرة من Cl-36 أنتجت عن طريق تعرض ماء البحر للإشعاع الناتج من الأسلحة النووية التي تم استخدامها في الفترة من 1952 إلى 1958. وزمن تواجد Cl-36 في الغلاف الجوي تقريبا أسبوع واحد. وعلى هذا، فإنه يستخدم لتحديد الماء الموجود في التربة والماء الجوفي في فترة الخمسينات من القرن العشرين. وعلى هذا فإن Cl-36 يستخدم للتعرف على الماء الأحدث من هذا التاريخ. ويستخدم الجيولوجين Cl-36 للتعرف على زمن الثلوج والرسوبيات.
يسبب الكلور تهيج في الجهاز التنفسي وخاصة للأطفال وكبار السن. وفي حالته الغازية فإنه يسبب تهيج الغشاء المخاطي وفي حالته السائلة يسبب حروق للجلد. ويتطلب وجود 3.5 جزء في المليون منه للتعرف على رائحته، ولكنه يتطلب وجود 1000 جزء في المليون أو أكثر ليصبح خطر. ولذلك تم استخدام الكلور في حالته الغازية في الحرب العالمية الثانية كسلاح كيميائي. شاهد استخدام غاز سام في الحرب العالمية الأولي. ولذلك لا يجب أن لا تتعدى نسبة الكلور 0.5 جزء في المليون (للشخص البالغ لفترة عمل تبلغ 8 ساعات – 40 ساعة عمل في الأسبوع تقريبا). التعرض الكثير للتركيز العالي (ليس مميتا) من الكلور يسبب وجود مياه في الرئة. والتعرض للتركيزات المنخفضة لفترات طويلة لغاز الكلور يؤدى لضعف الرئة، ويجعلها أسهل تأثرا بأمراض الرئة الأخرى. ويمكن تكون غازات سامة عند خلط المبيضات مع البول، الأمونيا أو أي منتجات تنظيف أخرى. وتتكون هذه الغازات من خليط من غازات الكلور، الكلورامين، ثلاثي كلوريد النيتروجين: وعلى هذا يجب الاحتياط لعدم حدوث مثل هذه التركيبات. |
يمكن استخلاص غاز الكلور عن طريق التحليل الكهربائي لمحلول كلوريد الصوديوم، مثلا من الماء شديد الملوحة. وهناك 3 طرق لاستخلاص الكلور بالتحليل الكهربي في الصناعة.
التحليل الكهربائي عن طريق خلية الزئبق كانت أول الطرق المستخدمة لإنتاج الكلور في الصناعة. ويتم وضع أنود تيتانيوم فوق كاثود زئبق، ووضع محلول كلوريد الصوديوم بينهما. وعند تمرير التيار الكهربي، ينطلق الكلور عند أنود التيتانيوم، بينما يذوب الصوديوم في كاثود الزئبق مكونا ملغم. ويمكن تحويل الملغمة إلى زئبق مرة أخرى بتفاعله مع الماء، مما ينتج الهيدروجين وهيدروكسيد الصوديوم. وهما منتجان ثاونيان نافعان. وهذه الطريقة تتطلب طاقة كبيرة، كما توجد محاذير بخصوص انبعاثات الزئبق. يتم استخدام حجاب من الحرير الصخري كراسب على كاثود من الحديد ليمنع الكلور المتكون على الأنود وهيدروكسيد الصوديوم المتكون على الكاثود من الاتحاد مرة أخرى. وتستهلك هذه الطريقة طاقة أقل من خلية الزئبق، ولكن تركيز هيدروكسيد الصوديوم لا يكون كاف للاستفادة به. يتم تقسيم خلية التحليل الكهربائي إلى قسمين عن طريق غشاء يعمل كمبادل أيوبي. يتم وضع محلول كلوريد الصوديوم المشبع في قسم الأنود، بينما الماء المقطر يوضع في قسم الكاثود. وهذه الطريقة فعالة تقريبا مثل التحليل الكهربي الحجابي، ولكنها تنتج هيدروكسيد صوديوم نقي للغاية. أنا ارى أنه من المهم دراسة عنصر الكلور من حيث الصفات والتغيرات ومعرفة فوائدة من أخطاره الجسيمة كما أنه شديد السمية كما ذُكر في البحث كما أنه يدخل بشكل مباشر في تركيب عدد كبير من المواد التي تستخدمها في حياتنا كالمنظفات والمبيدات وبشكل غير مباشر في المياه المعدنية |
كهرل ( Electrolyte) هو أي مادة تحتوي على أيونات حرة تشكل وسطا ناقلا للكهرباء . مثال للكهرل محلول مائي من حامض الكبريتيك. يتألف من أيونات الهيدروجين الموجبة و [ كب أ4 ] (SO4) ذات الشحنة السالبة في المحلول . والكهرل هو عضو من ثلاثة أعضاء لازمة للتوصيل الكهربائي في دائرة وهي في حالة الخلية الجلفانية مثلا : لوح نحاس + لوح زنك + كهرل . تُعرف الكهارل بالمحاليل الأيونية . ويوجد منها الكهارل المنصهرة و الكهارل الصلبة كما في البطارية الجافة .
يستعمل الكهرل في البطاريات ، كما يستعمل في الطلاء الجلفاني بالمعادن مثل الطلاء بالذهب و الطلاء بالزنك وغيرها . توجد الكهارل عادة في محاليل حمضية أو قلوية أو ملحية. كما تتصرف بعض الغازات ككهارل تحت درجات الحرارة العالية أو الضغوط المنخفضة. يمكن أيضا أن تنتج المحاليل الكهرلية من انحلال بعض البوليميرات العضوية ، مثل DNA و الهضميد (عديد الببتيد)) و البوليميرات التركيبية (مثل سولفات عديد الستيرين)، وتسمى عندئذ عديدة الكهرل ، والتي تحتوي على شحنات كهربائية متعددة. تتشكل المحاليل الكهرلية عادة عند وضع ملح في مذيب مثل الماء . حيث تذوب المكونات بسبب التفاعل الدينامي الحراري بين المذيب والجزيئات المذابة بعملية تسمى الذوبان . عندما يوضع ملح الطعام NaCl في الماء تتفكك الروابط بين أيونات الصوديوم و الكلور كالآتي: -NaCl(s) → Na+ + Cl |
الكهرل هو ببساطة مادة تذوب في الماء لتعطي محلولا ناقل للتيار الكهربائي.
يمكن أن يوصف الكهرل في المحلول بأنه مركز إذا كان ذو تركيز عالي للأيونات ، ويكون مخففا ًً إذا كان ذو تركيز منخفض للأيونات . إذا انحلت نسبة كبيرة من المادة الذائبة في الماء نحصل على تركيز عالي ، وإذا لم تنحل بالكامل نحصل على تركيز ضعيف . وهذه خاصية من خواص المركبات الكيميائية تعتمد على خواص المذيب وخواص المادة المذابة . يمكن استغلال ظاهرة وخواص الكهارل في استخراج العناصر، مثل استخراج الألمونيوم واستخراج المركبات المنحلة في المحلول. إن الأيونات الأساسية في علم وظائف الأعضاء (الفيزيولوجيا) هي الصوديوم +Na، والبوتاسيوم +K، والكالسيوم 2+Ca، والمغنيزيوم 2+Mg، والكلور -Cl، والفوسفات 3-PO4، والبيكربونات -HCO3. إن رمز الشحنة الكهربائية (-) أو (+) يشير إلى أن المادة تحتوي على أيونات . والأيونات عبارة عن ذرات ذات توزيع إلكتروني غير متوازن ، ناتج إما عن أكتساب الذرة لإلكترون زائد فتصبح سالبة الشحنة ، أو تفقد الذرة إلكترونا أو أكثر وتصبح موجبة الشحنة. ويحدث ذلك أحيانا خلال التحلل الكيميائي . ففي مثالنا أعلاه فقدت ذرة الصوديوم إلكترونا فأصبحت أيونا موجبا الشحنة ، واكتسبت ذرة الكلور الإلكترون المفقود من ذرة الصوديوم وأصبحت أيونا ذو شحنة سالبة. كل الأحياء المتطورة تحتاج إلى توازن كهرليتي معقد ودقيق بين الوسطين داخل وخارج الخلية (أي توازن بين عدد الشحنات السالبة وعدد الشحنات الموجبة). ويلعب الضغط الأزموزي دورا مهما ، وخصوصاً حفظ التدرج التناضحي (التنافذي) (Osmotic gradients)الدقيق للكهارل. هذا التدرج يؤثر وينظم توزيع الماء في الجسم (تميه)، وباهاء الدم، وهو أساسي لعمل الأعصاب و العضلات . ويوجد آليات مختلفة في الكائنات الحية تضبط بدقة تركيز الكهارل المختلفة. |
يعتبر كلا النسيجين العضلي والعصبي نسيجا كهربائيا في الجسم. حيث تفعّل العضلات والأعصاب بالفعالية الكهرلية بين السائل خارج الخلية أو الخِلالي كما يسمى ، وبين السائل داخل الخلية. يمكن للكهارل أن تدخل وتخرج من غشاء الخلية عن طريق بناءات بروتينية موجودة في الغشاء الخلوي المسمى بالقنوات الأيونية. فتقلص العضلات مثلاً، يعتمد على وجود الكالسيوم و الصوديوم و البوتاسيوم. فإذا لم تتوفر هذه الكهارل بمستوى كاف ، تعاني العضلات من الضعف أو من تقلصات عضلية أليمة.
يحفظ التوازن الكهرليتي بتناول مواد حاوية على الكهارل إما عن طريق الفم أو عن طريق حقنة ورديدية . وتضبط عن طريق هرمونات الجسم ، وتصرّف الكلية الكهارل الزائدة. يُنظم استقرار الكهارل في الجسم البشري بفضل الهرمونات ، تحليل الماء عند وجود كهرل ما ونطبق عليه جهدا كهربائيا تنتقل الكهرباء في الكهرل . يحدث تفاعل كيميائي عند المهبط مستهلكاً بعض الإلكترونات من المهبط. ويحدث تفاعل آخر عند المصعد منتجا إلكترونات يكتسبها المصعد. وتكون النتيجة أن تتجمع شحنة كهربائية سالبة في الكهرل حول المهبط ، وشحنة كهربائية موجبة حول المصعد. وتتحرك الأيونات في الكهرل لتعدل الشحنات الكهربائية السابقة بحيث يستمر التفاعل ويمر تيار من الإلكترونات. مثال: في محلول من الملح العادي (كلور الصوديوم NaCl) في الماء، سيكون تفاعل المهبط كالآتي: 2H2O + 2e− → 2OH− + H2 وستتشكل فقاعات غاز الهيدروجين التي تتصاعد وتغادر المحلول ، كما يجري التفاعل الآتي عند المصعد : -2H2O → O2 + 4H+ + 4e ويتشكل غاز الأوكسجين ويتصاعد في هيئة فقاعات . تُعادل شحنات الصوديوم (+Na) تلك الشحنة السالبة (-OH) عند المهبط ، كما تتعادل شحنة الكلور السالبة (-Cl) تتعادل مع الشحنة الموجبة (+H) عند المصعد . وبدون الأيونات الموجودة في الكهرل ، فإن الشحنات المحيطة بالمساري سوف تبطئ الجريان المستمر للشحنات الأخرى ، ذلك لأن سريان أيونات الماء : (+H) و (-OH) خلال الماء من مسرى لآخر يأخذ وقتا أطولا بالمقارنة بسرعة حركة أيونات الملح (+Na) و (-Cl) الغالبة عددياً. |
الخلية الجلفانية(Galvanic cell) و تسمى كذلك الخلية الكهركيمائية أو الخلية الفولتية و هي بطارية اخترعها العالم الإيطالي الأستاذ لويجي جلفاني أستاذ الطب في جامعة بولونيا و اكتشفها مصادفة سنة 1786 أثناء تجاربه حول فعل الكهرباء على عضلات الضفادع حيث لاحظ ارتعاش الضفدع في إحدى تجاربه عندما لمس طرفاه معدنين مختلفين في دائرة كهربائية مكتملة ، و ظن عندها ان مصدر الكهرباء يرجع إلى كهرباء حيوانية إلى أن جاء أستاذ الفيزياء أليساندرو فولتا الذي عزى ظهور الكهرباء إلى أن المعدنين مختلفين ، و استطاع فولتا فيما بعد أن يصنع بطارية من هذا النوع و سميت هذه الخلايا باسم أول من اكتشف تلك الظاهرة و هو جلفاني .
تتكون الخلية الجلفانية من نصفي خليتين . في كل واحدة منها يغطس قطب معدني مختلف عن الأخر ، وكما في الشكل أحد القطبان من معدن الخارصين Zn والآخر من النحاس Cu . ويغطس كل منهما في محلول لأحد أملاحه : الخارصين في محلول كبريتات الخارصين ZnSO4 ولوح النحاس في محلول كبريتات النحاس CuSO4. والخاصية الكيميائية هنا أن ذرات المعدن لها ميل لترك المعدن والدخول في المحلول ، وهي عندما تفعل ذلك فإنها تترك إلكترونات على اللوح وتدخل المحلول على هيئة أيونات موجبة الشحنة . وكل من أنصاف الخليتين له تفاعله مع محلوله. وهذا النظام يسمى باسم أول من أخترعه دانيل وتسمى تلك الخلية خلية دانيال. نجد أن ذرات الخارصين Zn لها ميل أكبر لدخول محلولها عن ذرات النحاس Cu . أي أن تراكم الإلكترونات على لوح الخارصين يكون أكبر من تراكمها على لوح النحاس . وبما أن الإلكترونات ذات شحنة سالبة يتكون على لوح الخارصين جهدا كهربي سالب الشحنة أكبر من الجهد الكهربي على لوح النحاس . ونظرا لعدم وجود توصيلة خارجية بين القطبين فلا يسير تيار ولا تنتقل الإلكترونات .  |
وعندما نوصل القطبين من الخارج بفولتمتر تبدأ الإلكترونات الانتقال من القطب Zn الأكثر سالبية إلى قطب النحاس Cu الأكثر إيجابيا (الموجب) . ونظرا لأن الإلكترونات ذات شحنة سالبة ينتج تيار كهربائي يسير في عكس اتجاه الإلكترونات . كما يسير في نفس الوقت في المحلول تيار من الأيونات بنفس شدة التيار الخارجي . وتدخل لكل إلكترونين يغادرين قطب الخارصين في الدائرة الخارجية إلى قطب النحاس ، تدخل ذرة خارصين Zn في المحلول على هيئة أيون موجب Zn2+ وذلك لتعويض الإلكترونين اللذان تركا لوح الخارصين من الخارج.
وطبقا للتعريف فالمصعد anode هو القطب الذي تحدث عليه الأكسدة ( افتقاد إلكترونات )، وعليه ففي الخلية الجلفانية يمثل قطب الخارصين المصعد . ونظرا لأن النحاس قد اكتسب إلكترونين عن طريق التوصيلة الخارجية ، يقوم هوالآخر بإعطاء إلكترونين إلى أيون نحاس Cu2+ من محلول كبريتات النحاس فيتعادل ايون النحاس ويترسب على لوح النحاس . وبحسب التعريف فالمهبط cathode هو القطب الذي يحدث عليه الاختزال (أي اكتساب إلكترونات )، فقطب النحاس هو المهبطد cathode. وتسير الإلكترونات من المصعد إلى المهبط في الدائرة الخارجية. يمكن تعيين فرق الجهد للخلية الكهربائية (القوة الدافعة الكهربية) بواسطة جدول جهد القطب القياسي للعناصر وذلك لكلا من نصفي الخلية . ونفترض عند اجراء هذا التعيين أن التيار المار بين قطبي الخلية يساوي صفرا . نبدا أولا باختيار المعدنين . ونبحث في الجدول القياسي standard electrode potential عن الجهد القياسي لكل من المعدنين Eo و يُعطى في الجدول بوحدة الفولت . فيكون فرق جهد الخلية مساويا لحاصل طرح الجهدين القياسين للمعدنين . |
وعلى سبيل المثال في الشكل لدينا محلولين كبريتات النحاس وكبريتات الخارصين ، وينغمس لوح نحاس في كبريتات النحاس كما ينغمس لوح خارصين في محلول كبريتات الخارصين . كما توجد قنطرة بين المحلولين ( وهذه يمكن الاستعاضة عنها بغشاء فاصل بين المحلولين) تسمح بمرور أيونات SO42− من محلول النحاس إلى محلول الخارصين ( وبذلك تتم الدائرة الكهربية عند توصيل اللوحين من الخارج بموصل .)
لدينا نصفي خلية ، واحدة للنحاس Cu والأخرى للخارصين Zn ، والتفاعلان الجاريان هما : التفاعل عند المصعد: Zn2+ + 2e- → Zn (E = -0.76 V التفاعل عند المهبط : Cu2+ + 2e- → Cu (E = +0.34 V; وحصلنا لنصف خلية النحاس على الجهد E = +0.34 V ولنصف خلية الخارصين على الجهد E = -0.76 V من الجدول القياسي . أي أن التفاعل الكلي الجاري في الخلية : Cu2+ + Zn → Cu + Zn2+. ونحصل على فرق جهد الخلية بحاصل الطرح : +0.34 - (-V 1.100 = ( 0.76 أي أن فرق جهد الخلية في حالة عدم مرور تيار خارجي تساوي 1.100 فولت . ويسمى هذا الجهد القوة الدافعة الكهربائية . |
المفاعلات النووية عبارة عن منشآت ضخمة يتم فيها السيطرة على عملية الأنشطار النووي حيث يتم الأحتفاظ بالأجواء المناسبة لأستمرار عملية الأنشطار النووي دون وقوع انفجارات أثناء الأنشطارات المتسلسلة. يسخدم المفاعلات النووية لأغراض خلق الطاقة الكهربائية و تصنيع الأسلحة النووية و ازالة الأملاح والمعادن الأخرى من الماء للحصول على الماء النقي و تحويل عناصر كيميائية معينة إلى عناصر أخرى و خلق نظائر عناصر كيميائية ذات فعالية اشعاعية واغراض أخرى.
يتوقع بعض الخبراء نقصا في الطاقة الكهربائية في المستقبل البعيد نتيجة ظاهرة انحباس حراري سببتها أنشطة بشرية مثل تكرير النفط ومحطات الطاقة وعادم السيارات وغيرها من الأسباب وهناك اعتقاد سائد ان الطاقة النووية هو السبيل الأمثل لسد هذا النقص في المستقبل. 1. مركز المفاعل وهو الجزء الذي يتم فيه سلسلة الأنشطار النووي. 2. السائل المتحكم في حرارة المركز ويستعمل الماء عادة للتحكم في سرعة النيوترونات وبالتالي معدل الانشطار النووي كما أنه ناقل للحرارة الناتجة من التفاعل النووي ويتحول جزء منه إلى بخار عال الضغط . 3. حاويات تحيط بمركز المفاعل و الماء ، مصنوعة من الحديد الصلب ذات جدران سميكة(نحو 25 سم) ، للاحتفاظ بضغط البخار عاليا ، ولمنع تسرب الأشعاعات الناتجة من الأنشطار النووي إلى الخارج والوقاية منها. يخرج بخار الماء بضغط يبلغ 400 ضغط جوي وتكون درجة حرارته نحو 450 درجة مئوية بواسطة أنابيب متينة من حاوية المفاعل . 4. محولات حرارية يأتي البخار عالى الضغط من المفاعل إلى المحولات لفصل دائرتي الماء ، الدائرة الأولية التي تلف في المفاعل وهذه نكون عالية الإشعاع. لذلك تُفصل عن الدائرة الثانوية للماء الساخن المضغوط ، ويتحول هذا الماء في الدائرة الثانوية عند مغادرته للمحول الحراري إلى بخار ماء عالي الضغط والحرارة ويوجه إلى توربين لتوليد الكهرباء . 5. مولد كهربائي عملاق يديره التوربين وتولد التيار الكهربائي . بذلك تتحول الطاقة النووية إلى طاقة حرارية ثم إلى طاقة حركة للتوربين والمولد الكهربائي إلى طاقة كهربائية لشغيل المصانع وإنارة المنازل . |
لغرض تحفيز سلسلة عمليات الأنشطار النووي في مركز المفاعل النووي يستعمل ما يسمى بالوقود النووي والتي هي في الغالب اليورانيوم-235 أو البلوتونيوم-239. والفكرة تكمن في تحفيز انشطار في أنوية ذرات اليورانيوم-235 و البلوتونيوم-239 لايصالهما إلى مرحلة ما يسمى الكتلة الحرجة.
لتوضيح مفهوم الكتلة الحرجة تصور ان هناك كرة بحجم قبضة اليد مصنوع من يورانيوم-235 ، بعد تحفيز اولي لعملية الأنشطار النووي بواسطة تسليط حزمة من النيوترون على الكرة سيتولد في المتوسط عدد 2.5 نيوترون جراء هذا الأنشطار الأول لنواة ذرة اليورانيوم-235 . وهذا يكون كافيا لبدأ انشطار ثان في نواة أخرى من اليورانيوم-235 ، وأثناء هذه السلسلة المتعاقبة من الأنشطارات في اليورانيوم يفقد الكثير من النيوترونات المتكونة وتخرج من سطح كرة اليورانيوم، وبفقد تلك النيوترونات يتوقف التفاعل النووي . ولكن يجب ان يكون معدل تولد النيوترونات داخل الكرة مساو على الأقل لعدد النيوترونات المتسربة إلى الخارج لاستدامة عمليات الأنشطار . وهنا يأتي دور الكتلة الحرجة التي يمكن تعريفها بالحد الأدنى من كتلة مادة نووية معينة كافية لدوام سلسلات متعاقبة من الأنشطارات . إذا كان العنصر المستخدم في عملية الأنشطار النووي ذو كتلة يتطلب تسليطا مستمرا بالنيوترونات لتحفيز الأنشطار الأولي للنواة فان هذه الكتلة تسمى الكتلة دون الحرجة. اذا كان العنصر المستخدم في عملية الأنشطار النووي ذو كتلة قادرة على تحمل سلسلات متعاقبة من الأنشطار النووي حتى بدون اي تحفيز خارجي بواسطة تسليط نيوترونات خارجية فيطلق على هذه الحالة الكتلة الفوق حرجة وهي المرحلة المطلوبة لتصنيع القنبلة النووية. |
عملية التخصيب عبارة عن عزل نظائر عناصر كيميائية محددة Isotope separation من عنصر ما لغرض زيادة تركيز نظائر أخرى للحصول على مادة تعتبر مشبعة بالنظير المطلوب على سبيل المثال عزل نظائر معينة من اليورانيوم الطبيعي للحصول على اليورانيوم المخصب و اليورانيوم المنضب. وتتم عملية التخصيب على مراحل حيث يتم في كل مرحلة عزل كميات أكبر من النظائر الغير مرغوبة حيث يزداد العنصر تخصيبا بعد كل مرحلة لحد الوصول إلى نسبة النقاء المطلوبة.
على سبيل المثال اليورانيوم المخصب عبارة عن يورانيوم تمت زيادة نسبة نظائر اليورانيوم-235 فيه وازالة النظائر الأخرى. وعملية التخصيب هذه صعبة و مكلفة وتكمن الصعوبة ان النظائر الذي يراد ازالتها من اليورانيوم شبيهة جدا من ناحية الوزن للنظائر الذي يرغب بالابقاء عليها و تخصيبها ويتم عملية التخصيب باستخدام الحرارة عبر سائل أو غاز لتساهم في عملية عزل النظائر الغير المرغوبة وهناك طرق أخرى أكثر تعقيدا كاستعمال الليزر أو الأشعة الكهرومغناطيسية. وتبلغ نسبة اليورانيوم-235 الذي يراد تخصيبه من اجمالي ذرة اليورانيوم الطبيعي نسبة 0.7% فقط ولكن هذا الجزء هو المرغوب فيه لكونه اخف من ناحية الكتلة من الأجزاء الأخرى من اليورانيوم الطبيعي . الجزء المتبقي من اليورانيوم الطبيعي بعد استخلاص جزء اليورانيوم-235 يسمى اليورانيوم-238. تم تخصيب اليورانيوم لأول مرة في الولايات المتحدة بعد الحرب العالمية الثانية حيث تم بناء 3 من المفاعلات النووية في ولايات تينيسي و أوهايو و كنتاكي وكانت الطريقة المستعملة عبارة عن ضخ كميات كبيرة من اليورانيوم على شكل غاز يورانيوم هيكسافلوريد uranium hexafluoride إلى حواجز ضخمة تحوي على ملايين الثقوب الصغيرة جدا وبهذه الطريقة يتم انتشار اليورانيوم-235 (وهو الجزء المطلوب) بسرعة أكبر نسبة إلى اليورانيوم-238 (وهو الجزء الغير مرغوب فيه لكونه أثقل) وتم استغلال الفرق في سرعة الأنتشار وجمع كميات هائلة من اليورانيوم-235 وتمتلك الولايات المتحدة يورانيوم مخصب من النوع العالي الخصوبة بنسبة 90%. المشكلة الكبرى تكمن في كيفية التخلص من المخلفات النووية الناتجة في المفاعلات النووية. وعادة ما يوضع اليورانيوم المستهلك في احواض مائية كبيرة لمدة عشرات السنين لغرض تخفيض أشعاعها النووي إلى حد يسهل معاملتها صناعيا بعد ذلك . وعندها يمكن اختيار طريقة من بين طريقتين لمعاملتها : أما تجهيزها وتغليفها استعدادا لدفنها في الطبقات الجيولوجية العميقة (على عمق 800 إلى 1000 متر) تحت الأرض بعيدا عن السكان ، أو الطريقة الأخرى وتتضمن معالجة اليورانيوم المستهلك كيميائيا لفصل البلوتونيوم-239 عن النفايات المشعة. بعد ذلك يمكن استغلال البلوتونيوم-239 في تصنيع كابسولات جديدة يمكن اعادة استخدامها في المفاعل لتوليد الطاقة الكهربائية ، إذ أن البلوتونيوم-239 له نفس الخواص النووية التي يتميز بها اليورانيوم-235 ويصلح لإنتاج الطاقة الكهربائية . أما النفايات المتبقية من المعاملة الكيميائية فيمكن التخلص منها أولا بخلطها بمسحوق الزجاج ثم صهر المخلوط فتصبح النفايات محتجزة في الزجاج الذي يـُصب في أوعية أسطوانية من الحديد الصلب أرتفاعها 120 سم وقطرها 40 سم . وتخزن تلك الأسطوانات شديدة الاشعاع إلى حين بناءالمطرح النهائي للتخلص منها تحت الأرض. والمهم في الطريقة الثانية لمعالجة اليورانيوم المستهلك أنها طريقة لتدوير المواد النووية لاستعادة استخدامها من خلال العملية الكيميائية لفصلها عن النفايات المشعة .وقد اختارت أنجلترا وفرنسا هذا الطريق لما له من فائدة نحو تدوير المواد النووية وإعادة استخدامها. وتقوم كل من إنجلترا في سيلافيلد Sellafield وفرنسا في لاهاج La Hague بتدوير المواد النووية المستهلكة الناتجة من تشغيل مفاعلاتهم. |
| الساعة بإيدك هلق يا سيدي 18:12 (بحسب عمك غرينتش الكبير +3) |
Powered by vBulletin® Copyright ©2000 - 2024, Jelsoft Enterprises Ltd.
ما بخفيك.. في قسم لا بأس به من الحقوق محفوظة، بس كمان من شان الحق والباطل في جزء مالنا علاقة فيه ولا محفوظ ولا من يحزنون